Science|深度学习对抗原序列的通用编码指导免疫治疗
免疫反应涉及抗原识别细胞和信号分子的协调配合,以对病原体的特异性反应。尽管系统免疫学提供了越来越多的参与抗原特异性免疫反应的分子相互作用。但仍然缺乏对不同抗原特征如何介导反应的理解。
近日,在Science顶刊上,Achar等人发表了题为“Universal antigen encoding of T cell activation from high-dimensional cytokine dynamics"的文章,通过机器人平台与机器学习相结合,对T细胞活化进行实验测量和理论建模,研究广泛的功能性T细胞对不同抗原刺激反应的数据来解决这个问题。使用机器学习,作者构建了一个简化的地图,可以将6种不同的抗原依赖性免疫反应的类别分开。了解这种抗原编码可以帮忙指导免疫治疗,包括工程化嵌合抗原受体(CAR)-T细胞和识别疫苗抗原。
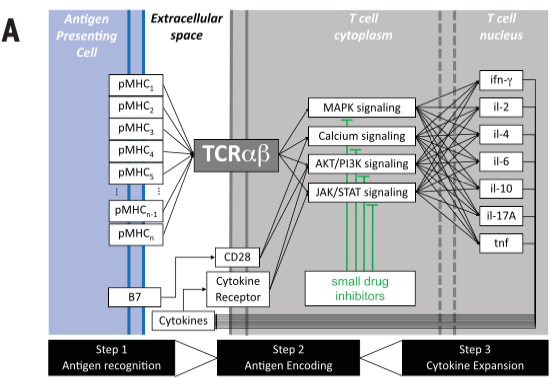
免疫反应是对时间有依赖性的。例如PD-1蛋白的表达与T细胞激活或衰竭相关,具体取决于时间和环境。这种复杂性源于多个配体(抗原)与单基因T细胞受体(TCR)结合触发的多变量反应。不同的小分子抑制剂的刺激会影响不同的细胞因子的激活模式(图A)。
(A)T细胞的TCRαβ信号转导机制参与pMHC配体(抗原)的所有组成部分,触发信号转导级联,并刺激功能反应(例如,细胞因子分泌)
作者专注于模拟T细胞对靶蛋白上的抗原的应答,以机器人方式生成T细胞激活的高精度、多维度动力学数据,并应用监督机器学习来学习信息的动态编码。
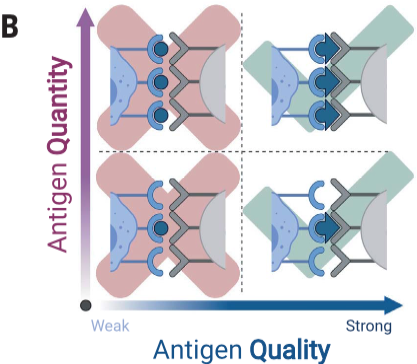
目前对T细胞应答的理解定义了抗原的三个功能类别:非激动剂、弱激动剂和强激动剂,根据它们对胸腺选择的影响分为death by neglect, positive selection和negative selection。该概念引出了抗原质量的概念,该概念已被证明可用于预测病毒或肿瘤是否可以成功根除,但难以从抗原序列中预测。
评估抗原质量通常涉及测量触发50%的最大免疫反应(EC50)的抗原水平。然而,抗原质量(antigen quality)应该被定义为一种绝对属性,因为大量的弱抗原(higher quantities of weak antigens)在功能上与少量的强抗原(low quantities of strong antigens)并不能简单的画等号[1]。
(B)T细胞必须解卷积质量和数据才能准确区分抗原
作者通过不同数量和质量的抗原(即不同的肽序列)测量了T细胞活化过程中多种细胞因子的动力学。
抗原编码解释免疫激活
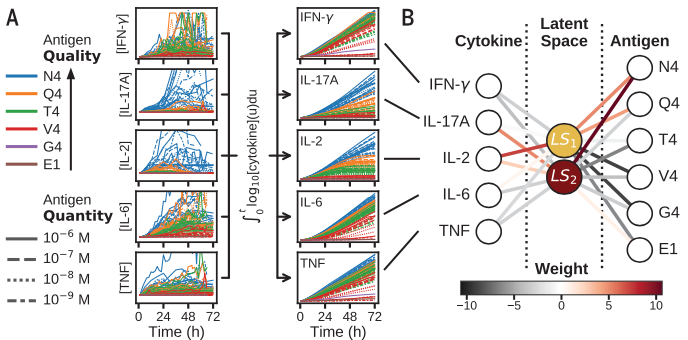
为了帮助解释免疫激活,作者使用机器学习分析和分类这些复杂的动态。使用对数转换的细胞因子浓度随时间的累积积分,作者训练了神经网络,该网络根据抗原序列对细胞因子动力学进行监督分类,与抗原数量无关。
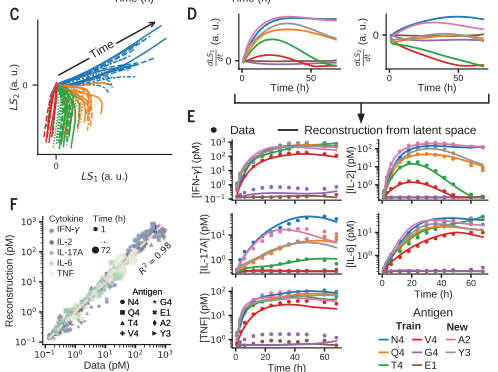
对不同质量和数据的OT-1抗原(左)的五种细胞因子的动力学进行预处理(A)并通过训练的对抗原序列的二维编码(LS1,LS2)的三层神经网络对抗原序列进行分类
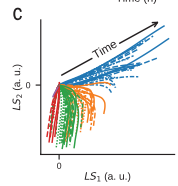
作者使用有两个节点的二维编码(LS1,LS2)学习框架对抗原质量分类。通过训练后,将数据投影到一个2维编码(LS1,LS2)的隐空间,五维(5D)细胞因子时间过程被压缩成二维轨迹。2D轨迹根据抗原序列可以很好地分离,并且与抗原数量无关。如下图C
通过对细胞因子的动力学的时间过程的2维隐空间的编码(LS1,LS2),根据抗原质量可以对T细胞活化进行分层
作者将深度学习对抗原质量进行分类的中间输出的二维编码隐空间称为“抗原编码”以强调T细胞应答如何根据抗原质量(由抗原序列确定)进行分类。
作者还测试了二维抗原编码是否保留了系统的高维动力学信息。作者构建了一个非线性解码器来从2D编码空间重建整个5D细胞因子动力学(图 D到F)证明基本上没有信息损失。预测模型训练之外的2个抗原的2D抗原编码也重建了5D细胞因子动力学原始数据(图 E和F)。
(D)不同抗原质量的隐空间轨迹示例。(E和F) 从隐空间轨迹对细胞因子时间序列的非线性重建产生了与实验数据的准确拟合(E)证明了抗原编码的完整性 [此处介绍了四种肽抗原:EIINFEKL(E1)、SIIGFEKL(G4)、 SIYNFEKL(Y3) 和 SAINFEKL(A2)] (F)
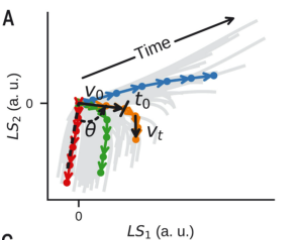
作者又使用数学模型来获得关于抗原编码的更多生物学见解。使用4个参数的数学方程(ballistic equations)拟合隐空间中的细胞因子轨迹,包括以初始速度v0为特征的初始激活,然后是衰减,
隐空间的细胞因子轨迹可以拟合四参数数学方程ballistic equations
作者发现拟合参数与抗原质量的EC50测量值之间存在很强的相关性。
尽管一个参数 ( v t ) 是恒定的,但其他三个参数 ( v 0、θ 和t 0 ) 具有很强的相关性
这证明了一个参数足以描述每个轨迹,从而通过隐空间的连续动态定义抗原质量。最终,通过将非线性解码器与作者的单参数模型相结合,获得了细胞因子动力学的生成模型。
抗原编码解释免疫环境的影响
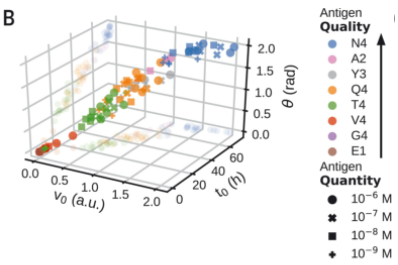
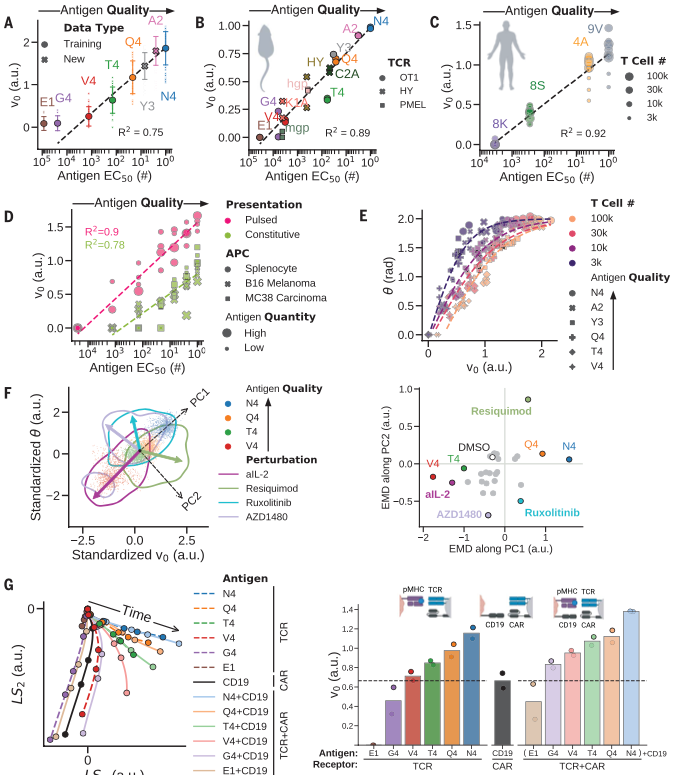
( A ) 在所有 OT-1 抗原上测试隐空间的数学模型得到与它们的等级相关的v 0测量值(由功能性剂量反应的 EC 50定义。(B到D)从OT-1 T细胞中学习的抗原编码产生准确的v 0排序与不同的小鼠TCR转基因T细胞(B)人类TCR转基因T细胞(C)和OT-1 T细胞响应组成性表达抗原的肿瘤 (D)。( E ) 抗原编码在 ( v 0 ,θ) 空间。( F ) 左:抗原编码 ( v 0 ,θ)在各种分子扰动下的 T 细胞活化。右图:单个抗原的Earth mover’s distance(EMD)。PC1 捕获抗原质量的变化 (EMD2 = 0)。尽管大多数分子扰动只是降低了表观抗原性(EMD1 < 0,EMD2 ≈ 0),但 JAK 抑制剂(AZD1480 和 ruxolitinib)严重影响 T 细胞活化(EMD2 < 0),而 TLR7/8 激动剂瑞喹莫特增强了它(EMD2 > 0) . ( G ) 抗 CD19 CAR-T 细胞(左)的抗原编码揭示了细胞因子反应的弱激活和拮抗模式(右)。
作者首先将参数V0绘制的EC50的函数(包括训练集和测试集),并恢复了高于最小阈值的对数线性相关性。细胞因子动力学模型产生了抗原质量的测量值V0,达到了与源自测量的功能剂量反应的EC50一样的效果。进一步证实了V0的对以下额外的免疫学设置的情况下的预测能力:
(1)OT-1 T细胞的两种分化状态;(2)不同的抗原呈递细胞;(3)不同的小鼠TCR转基因T细胞;(4)表达TCR转基因的人类T细胞;(4)不同肿瘤的抗原表达。在所有设置中,隐空间的结构都得到了保留,并且V0根据其质量准确地对抗原进行了排序。总体而言,作者的模型很好地概括了从看不见的免疫激活模式推断抗原质量。
测试了分子扰动(小药物抑制剂、细胞因子或抗体阻断)是否可以产生新的细胞因子动力学。对于大多数扰动,抗原编码参数之间的强相关性保持不变,并且保留了抗原层次结构,尽管表观抗原质量有所下降。然而,两种类型的扰动(先天信号传导的激活和细胞因子信号传导的抑制)最大程度地破坏了该参数相关性并产生了不同的动态模式,即具有潜在新功能的新型 T 细胞激活。
还研究了经基因工程改造的 T 细胞,可表达针对 B 细胞白血病 (CD19) 上表达的配体的嵌合抗原受体 (CAR),如用于复发性淋巴瘤患者,CAR-T细胞释放和消耗细胞因子的动力学与天然T细胞的轨迹相似。
作者的方法在 T 细胞激活期间产生了大型的多路动力学测量和通用抗原编码的定量模型。尽管经典方法已经定性地定义了三个离散的抗原类别,但作者严格推导出连续参数化的抗原质量。作者应用信息论来量化和解释 T 细胞活化的表型多样性,而不是在单个时间点进行的功能测定。该模型的普遍性应证明对量化和微调用于免疫疗法和疫苗开发的抗原强度有用。因此,机器人平台与机器学习和数学建模相结合,为研究高维生物动力学提供了定量工具,并可能有助于优化治疗策略。
参考文献
[1] P. François, G. Altan-Bonnet, J. Stat. Phys. 162, 1130–1152(2016)回复SCI 获取所有论文
数据与代码地址
https://zenodo.org/record/5759148#.YojZpJNBycY
https://github.com/soorajachar/antigen-encoding-pipeline