美国基因编辑先驱张锋发表新工具:编辑RNA可治疗多种顽疾
作为首位将基因编辑系统CRISPR用于哺乳动物细胞的开拓者,美国博德研究所华人科学家张锋近来对RNA编辑产生了兴趣,一月内连发两篇相关论文在顶级学术期刊。
美国东部时间10月25日,国际学术期刊《科学》发表了张锋团队一篇介绍CRISPR新系统“REPAIR”的文章。“REPAIR”的基本元件是一种取名为PspCas13b的酶和ADAR2蛋白。“REPAIR”可高效地修复RNA的单个核苷,因不会改变DNA信息而更为安全,将为基础研究和临床治疗提供一个新的工具。
Cas13酶家族最近受张锋团队青睐。10月4日,在发表于《自然》期刊的论文上,张锋团队证实了另一种酶Cas13a能够在哺乳动物细胞中特异性地下调内源性RNA和报告RNA的水平。
“基因编辑的首要目标是矫正导致疾病的突变。现在,我们已经很擅长让基因失活,但要修复已丢失的蛋白质功能则更具挑战得多。编辑RNA这一新技能打开了更多的可能,几乎可以在所有细胞中修复蛋白质功能,有助于多种疾病治疗。”张锋表示。
和此前CRISPR系统用于编辑DNA不同,张锋团队在普雷沃氏细菌(Prevotella)中找到了PspCas13b酶。这是Cas13酶家族中能使RNA失去活性的“佼佼者”,是潜在的RNA“剪刀”。
但张锋团队赋予PspCas13b的“使命”不是去让RNA失活,相反的,他们设计了PspCas13b的“变体”。这个“变体”失去了“剪刀”的功能,但会牢牢地结合在特定的RNA片段上。同时,PspCas13b“变体”的搭档——ADAR2蛋白会将该片段上的腺嘌呤核苷(A)替换成次黄嘌呤核苷(I)。
为何要做此替换?原来,鸟嘌呤核苷(G)突变为腺嘌呤核苷(A)时有发生,而这被认为和杜氏肌营养不良症、帕金森病等疾病密切相关。
人类的很多疾病信息都编码在DNA这个“生命脚本”上。基因编辑技术的出现使得科学家有了修改DNA的可能,给治愈疾病带来希望。但由于基因承载着生命最根源的信息,对DNA进行编辑有着安全和伦理上的顾虑。
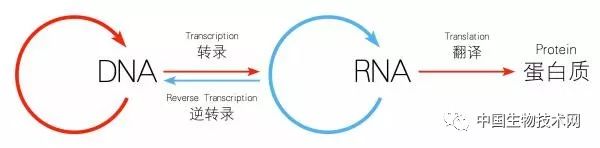
RNA编辑有所不同。RNA是以DNA单链为模板的遗传信息载体。DNA发出 “错误指令”,经RNA转录,翻译给蛋白质并执行功能,才有疾病的表现。若中途拦截,矫正RNA上的错误信息,让蛋白质接收到正确的信息,可起到治疗效果。
DNA与RNA之间的关系
安全和灵活是“REPAIR”的优势。“REPAIR无需篡改基因组就可以修复突变。而且RNA会自动降解,对它的修改或是可逆的。”张锋实验室学生、该论文的共同第一作者David Cox表示。
为了让“REPAIR”更加成熟,张锋团队对其进行了优化,设计出“REPAIR2”版本,将在转录组中可检测到的脱靶次数从1.8万次降至20次。据介绍,“REPAIR2”对目标RNA的编辑效率为20%-40%,最高达到51%。
为验证“REPAIR”系统在疾病治疗上的潜力,张锋团队人工合成了会造成范科尼贫血和X连锁性肾源性尿崩症的突变,并将这些突变引至人体细胞中,最后成功通过“REPAIR”在RNA层次上修复了致病突变。
接下来,张锋团队表示将继续从自然界寻找线索,设计其他附件,适用于更多类型的核苷酸修复。
中国生物技术网诚邀生物领域科学家在我们的平台上,发表和介绍国内外原创的科研成果。
注:国内为原创研究成果或评论、综述,国际为在线发表一个月内的最新成果或综述,字数500字以上,并请提供至少一张图片。投稿者,请将文章发送至weixin@im.ac.cn。
本公众号由中国科学院微生物研究所信息中心承办
微信公众号:中国生物技术网 回复关键词“热点”可阅读热点专题文章,包括“施一公”、“肠道菌群”、“肿瘤”、“免疫”和“健康”