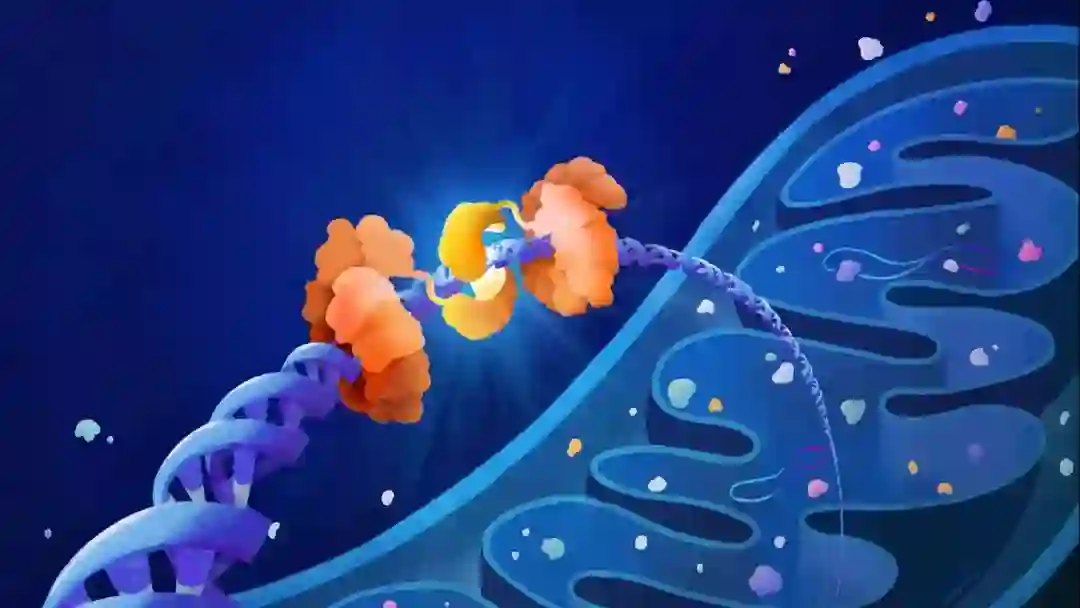
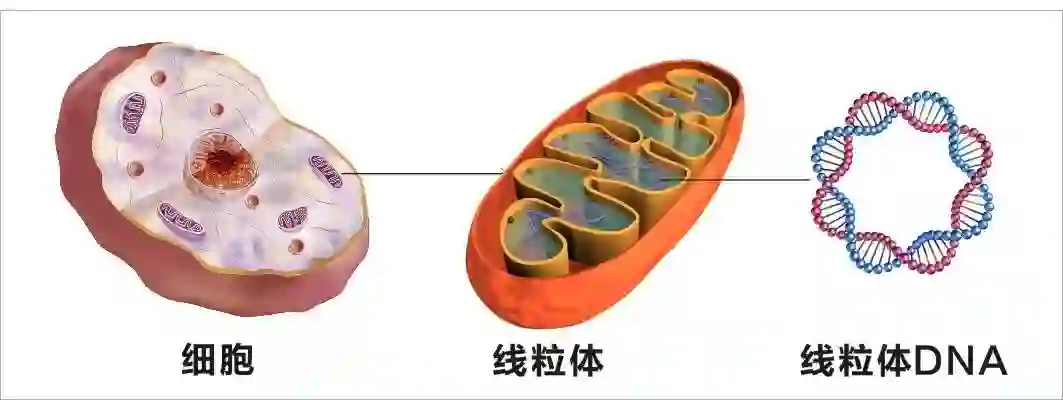
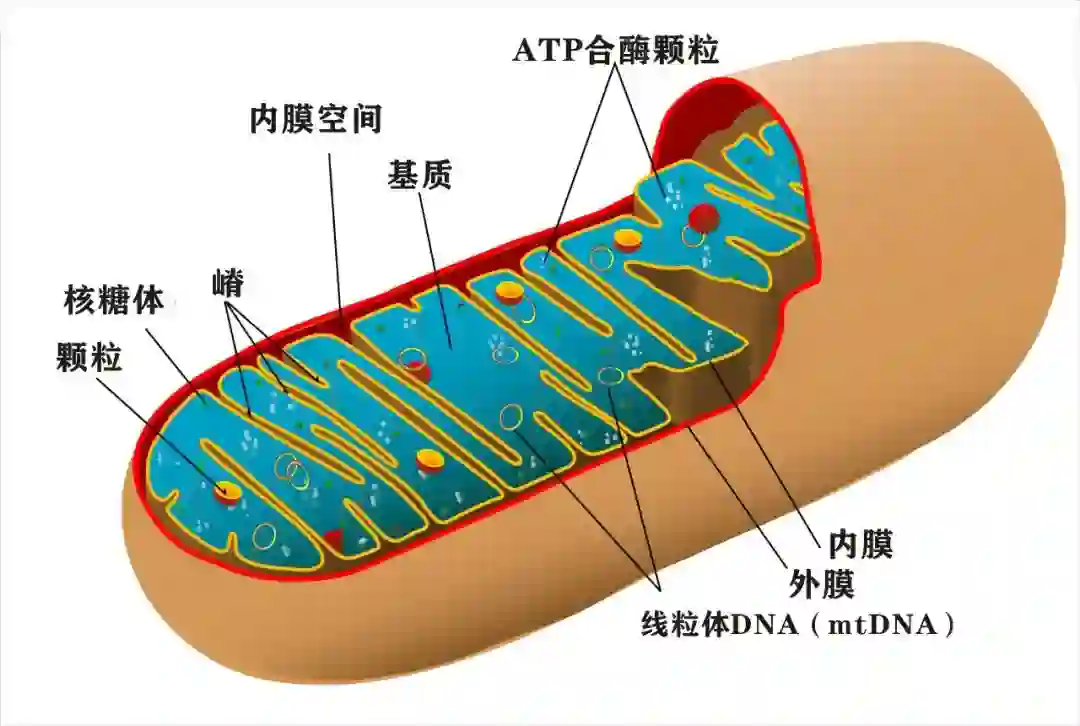
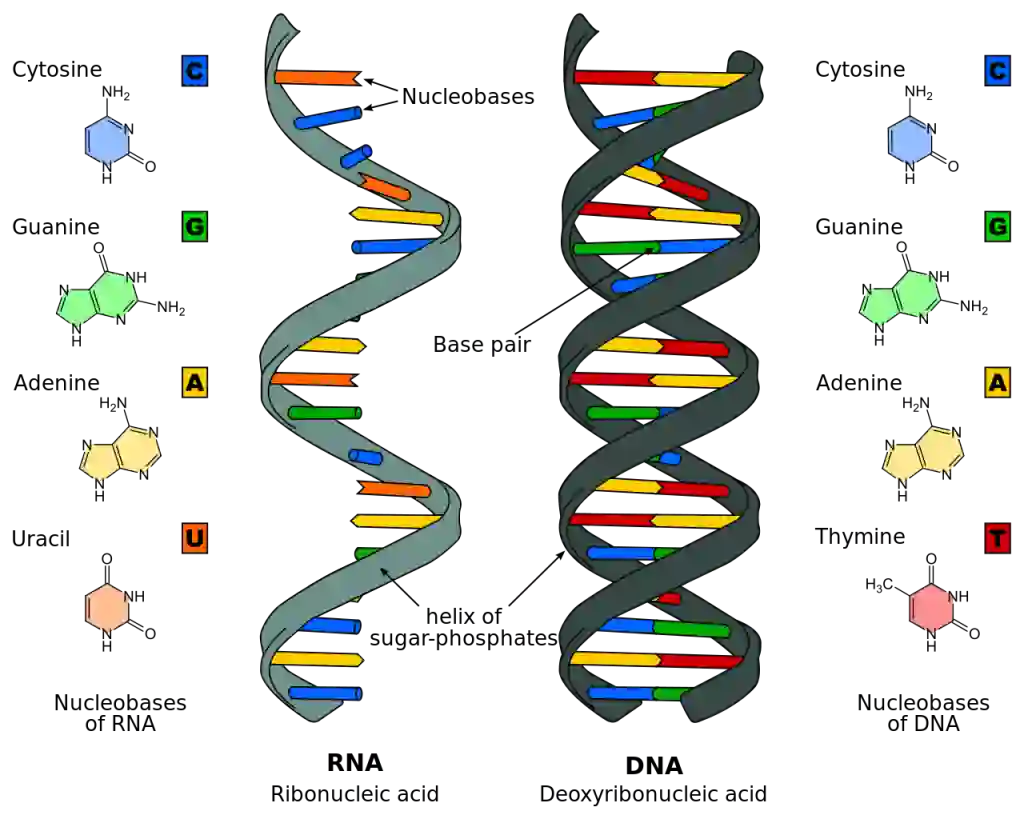
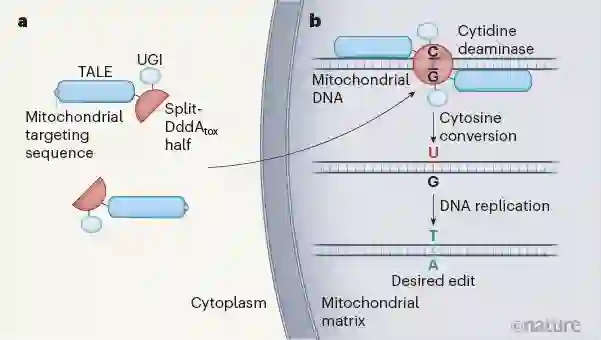
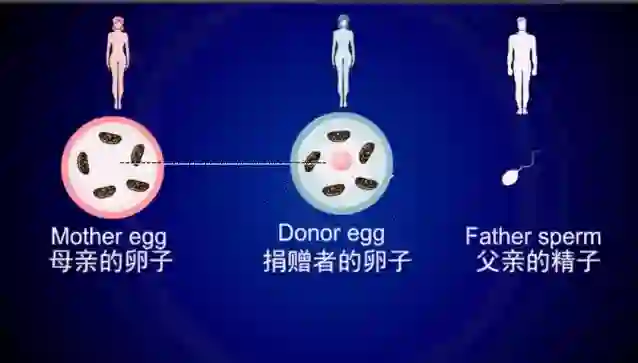
Nature:开创新时代!刘如谦团队首次实现线粒体精准基因编辑,无需CRISPR系统




想要了解更多学术进展、前沿科技资讯,参与学术头条每日话题讨论,可以扫描二维码或搜索 AMiner308 添加学术君微信,对学术君说: “我想进读者群”, 即可进入读者群,不定期发福利~

学术君微信
登录查看更多
相关内容
专知会员服务
36+阅读 · 2019年12月12日
Arxiv
8+阅读 · 2019年11月4日





