西湖大学重磅新研究!深入破解新冠病毒如何侵入人体
新智元推荐
新智元推荐
来源:西湖大学
编辑:元子
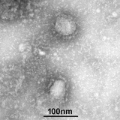
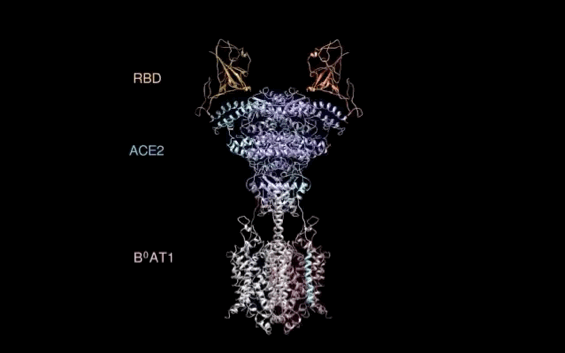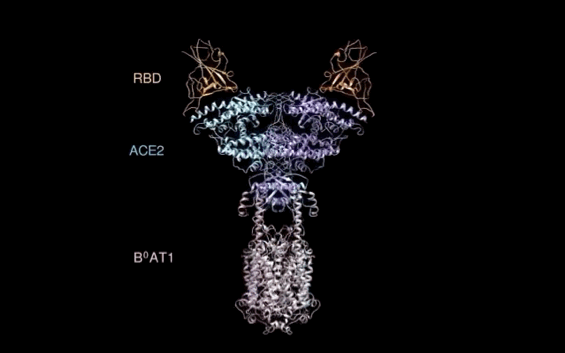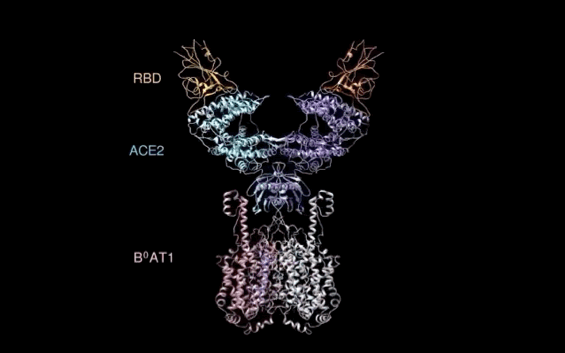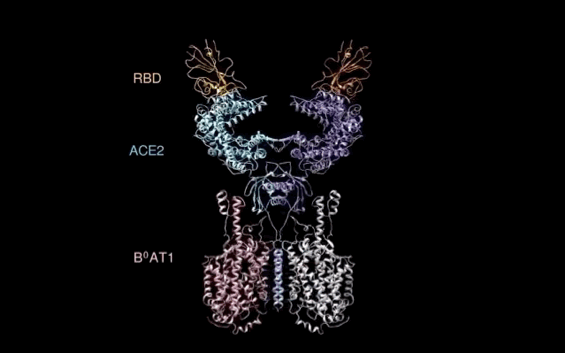
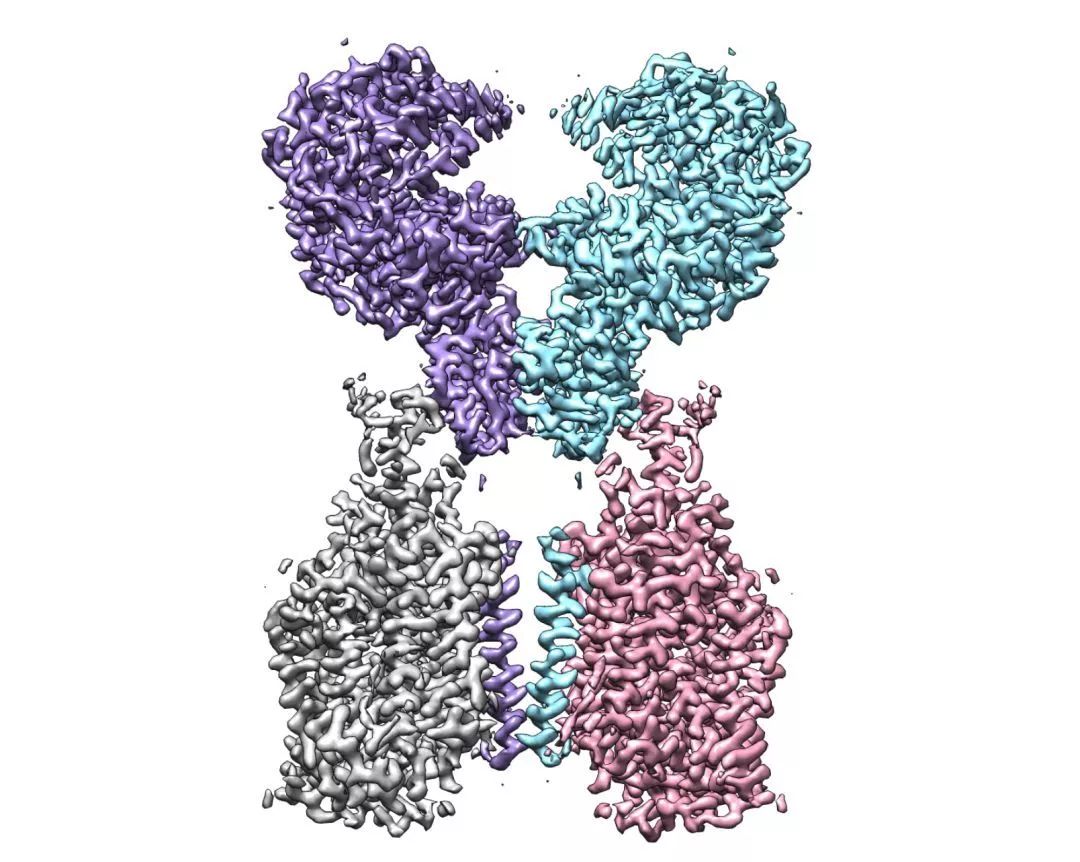
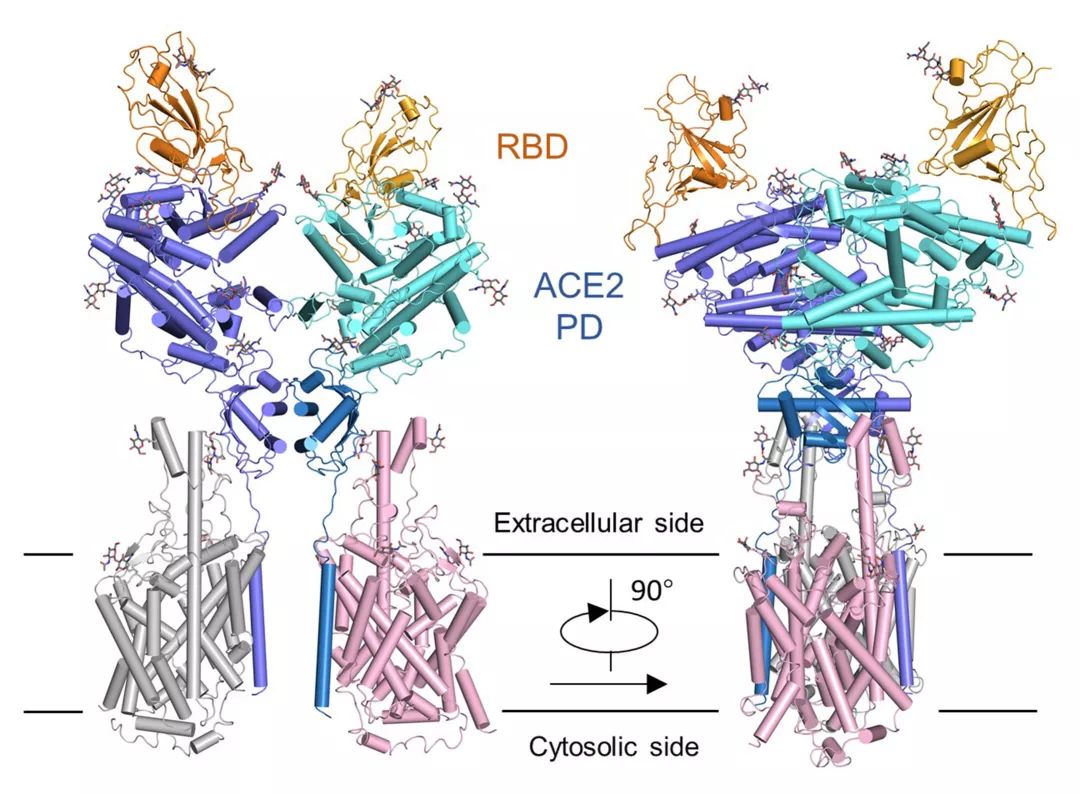
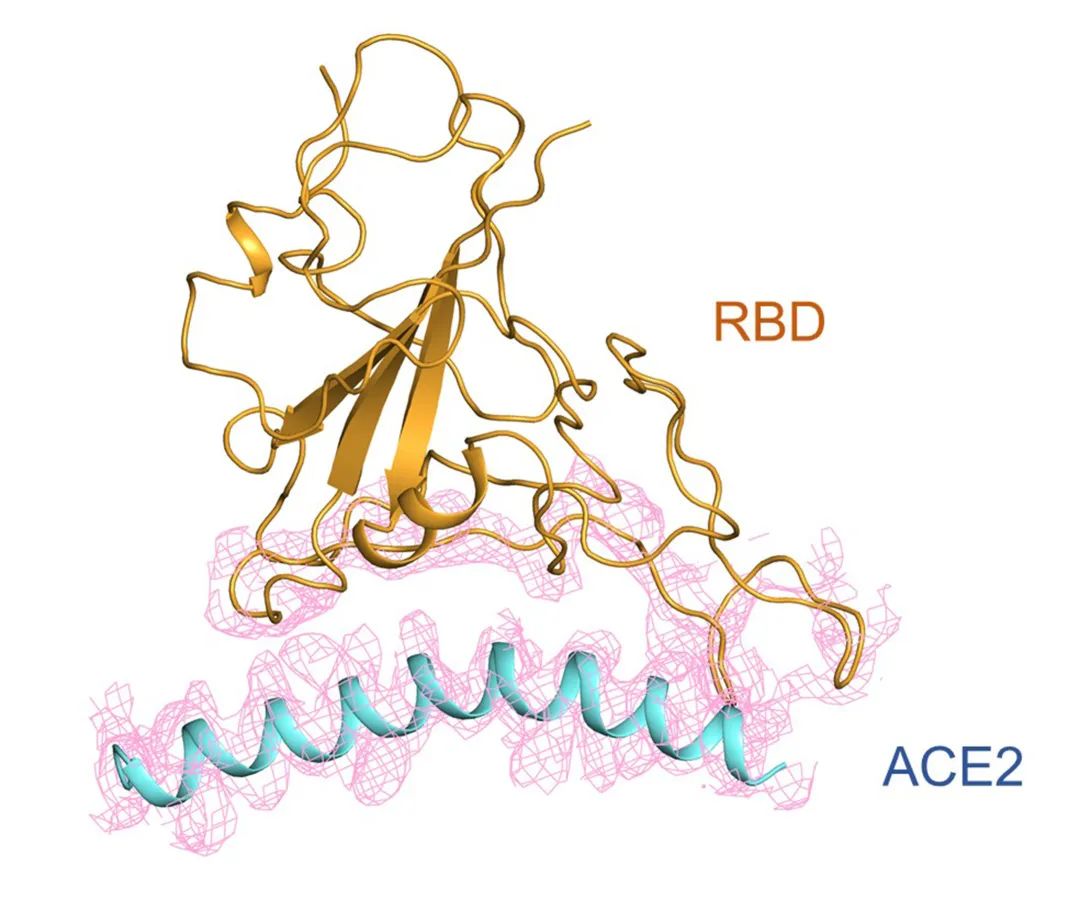
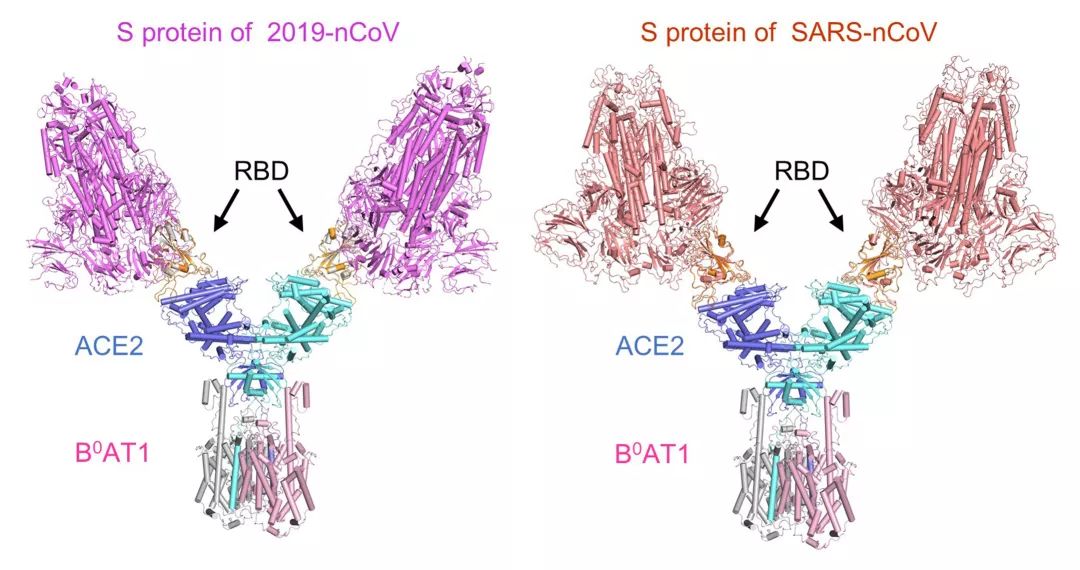
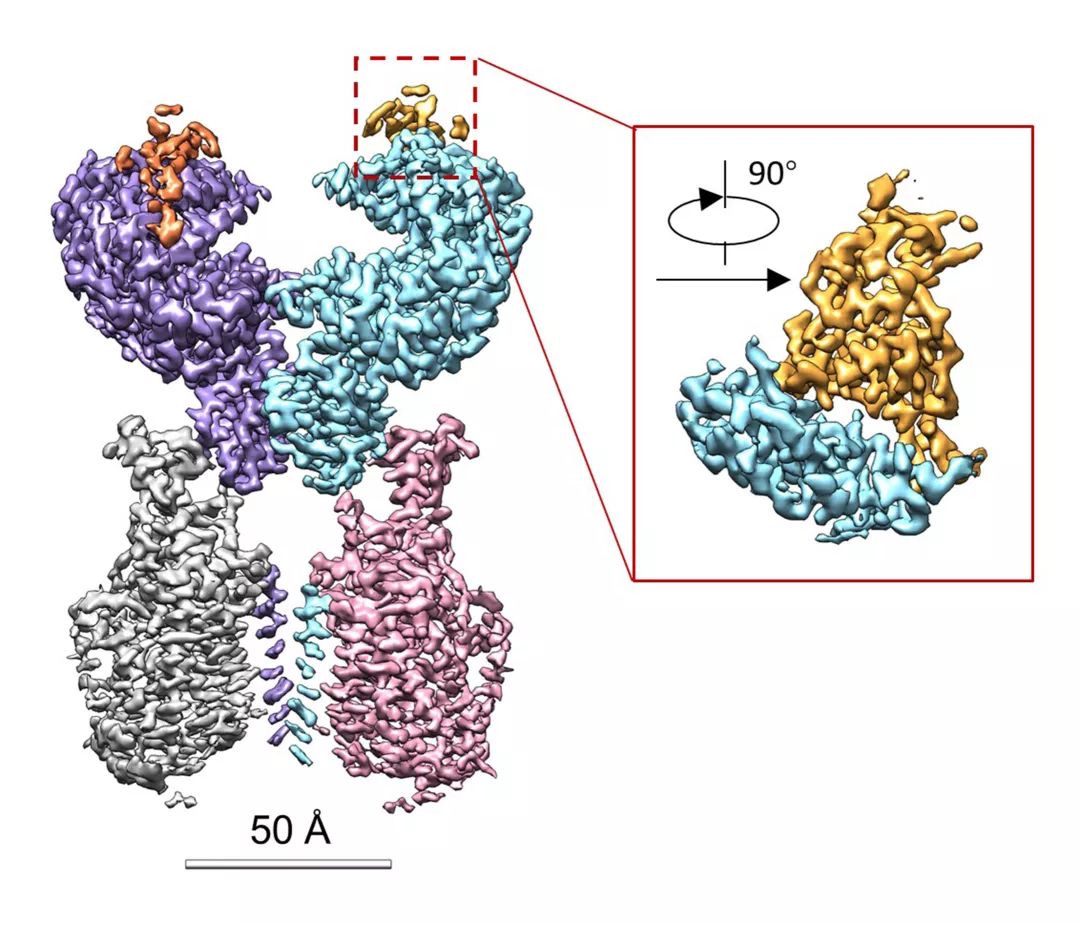
【新智元导读】此前发现新冠病毒受体ACE2全长结构的西湖大学再次取得重大突破!北京时间2月21日凌晨,周强研究团队在论文预印本网站BioRxiv再次发文,报道新冠病毒表面S蛋白受体结合结构域与细胞表面受体ACE2全长蛋白的复合物冷冻电镜结构,揭开了新冠病毒入侵人体细胞的神秘面纱。「新智元急聘主笔、编辑、运营经理、客户经理,添加HR微信(Dr-wly)或扫描文末二维码了解详情。」

登录查看更多
相关内容
Arxiv
14+阅读 · 2019年9月17日
Arxiv
6+阅读 · 2019年7月17日
Arxiv
5+阅读 · 2018年1月26日