病例分享 | T细胞大颗粒淋巴细胞白血病转化为侵袭性淋巴瘤
T细胞大颗粒淋巴细胞白血病(T-LGL)是细胞毒性CD3+T细胞的克隆性扩增,占淋巴增殖性疾病的5%。临床特征包括中性粒细胞减少引起的反复细菌感染、多种机制导致的贫血及类风湿关节炎等自身免疫性疾病。T-LGL是惰性疾病,感染是死亡的主要原因。Belhadj医师在《血液学》(Haematologica)杂志报告了2例T-LGL克隆性演变为侵袭性T细胞淋巴瘤的病例。
病例1
女性患者,55岁,于2010年体检时发现淋巴细胞增多,8×109/L;外周血见典型的大颗粒淋巴细胞(LGL),免疫表型CD3+、CD4+、CD8+、CD5+、CD7-、CD56-、CD16-、CD57-,克隆性TCRγ重排。2年后,该患者出现疲劳、盗汗、肝脾肿大、颈部和腋下淋巴结肿大,白细胞132×109/L,中性粒细胞17×109/L,血小板314×109/L,血红蛋白133g/L,存在肿瘤溶解综合征和乳酸酸中毒表现。
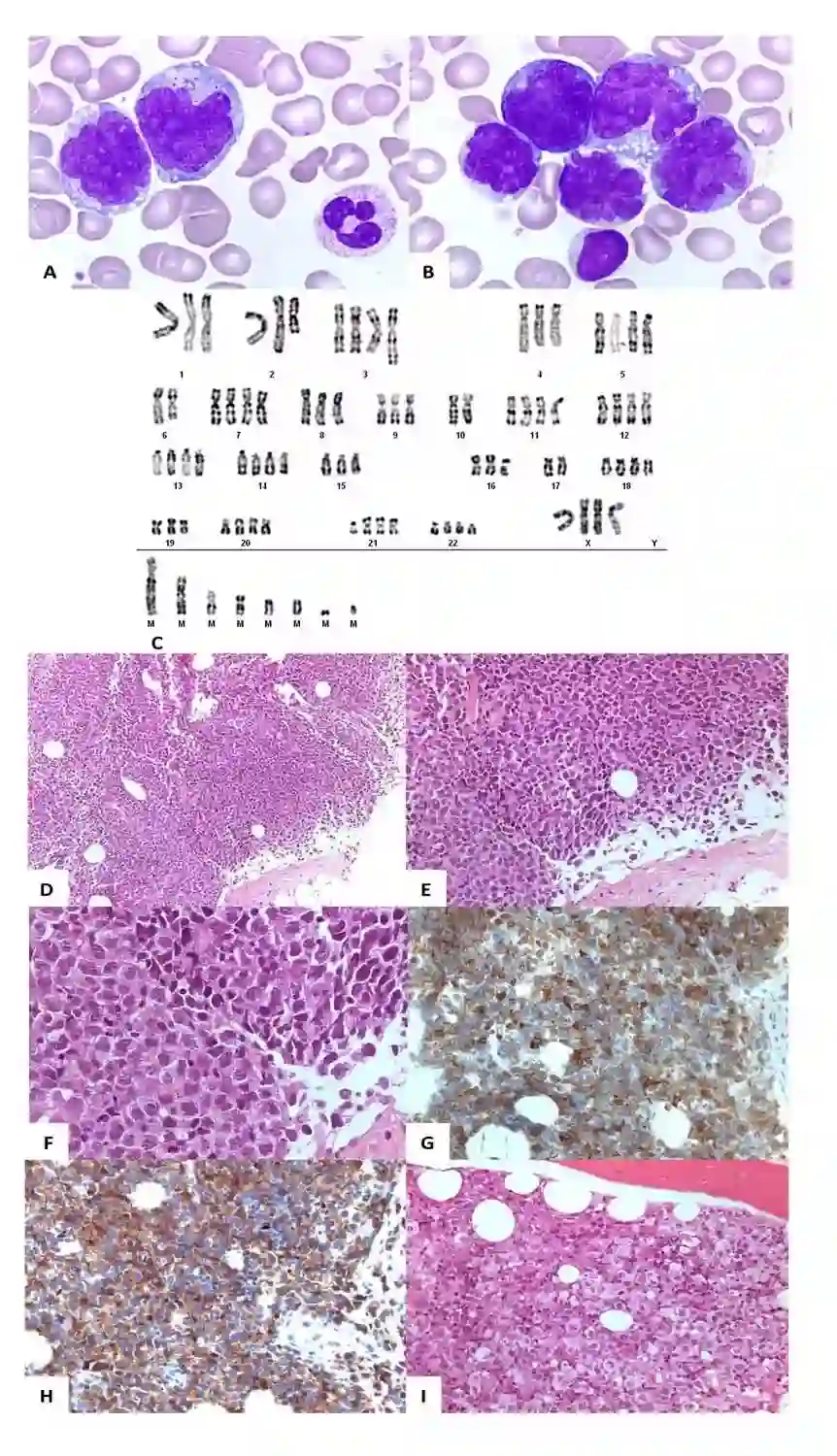
外周血涂片发现大部分淋巴细胞胞质丰富、中度嗜碱、含有颗粒和空泡、胞核不规则(图1 A、B),表型与T-LGL相同,但CD3弱表达。核型为超倍体和复杂核型,FISH分析检测到17p缺失 (图1C)。淋巴结活检见中等和较大不典型细胞弥漫性浸润,胞核不规则且多形性,无核仁,胞质丰富(图1 D、E、F)。肿瘤细胞CD5+、CD4+、CD3+/-、CD30+、颗粒酶B+和TiA1+(图1G、H),与骨髓有相同的增殖表现(图1I),并检测到同一克隆TCR重排,证实CD4+T-LGL已转化为侵袭性T细胞淋巴瘤。TP53基因发现2个突变:其一是第8个外显子R282W突变,根据IARC TP53数据库,为病理性突变,2010年血液中变异等位基因频率(VAF)6%,目前为1%。第二个突变是第5外显子V157I,2010年和疾病转化时均可检测出,皮肤活检证实为胚系突变。未检测到STAT3或STAT5B突变。
患者接受CHOP方案(环磷酰胺、阿霉素、长春新碱、泼尼松)2周期,CHOEP方案(环磷酰胺、阿霉素、长春新碱、依托泊苷、泼尼松)3周期,DHAX方案(地塞米松、大剂量阿糖胞苷、奥沙利铂)1周期,均无效。随后,该患者接受1周期大剂量甲氨蝶呤+左旋门冬酰胺酶治疗,获得完全缓解,BEAM方案(卡莫司汀、依托泊苷、阿糖胞苷、美法仑)预处理后行自体干细胞移植(ASCT),但ASCT后疾病迅速进展,患者死亡。
图1 病例1细胞遗传学和病理学分析。A、B.血涂片见大淋巴细胞,胞质丰富,中度嗜碱,含有颗粒和空泡,核不规则。C.复杂近4倍体核型,79~89,XXXX,-1,-2,add(2)(q23),-3,der(3)t(1;3)(q31;q27),-4,-6,-6,del(6)(q?q?),-8,-9,-10,-10,-15,-16,-17,-17,-19,i(21)(q10)x3,+7~14mar[cp16]。Ish 17p13.1 (TP53,17qtel)×2,mar(TP53-,17qtel++)×3[8]。D、E、F.淋巴结活检见中等和较大细胞弥漫性浸润,胞核不规则且多形性,胞质丰富。G、H. 免疫组化见肿瘤细胞CD3+和CD4+。I.骨髓内见到同样的细胞
病例2
女性患者,30岁,于2011年出现中性粒细胞减少(0.76×109/L),淋巴细胞2.8×109/ L,外周血涂片LGL细胞占淋巴细胞的61%(1.7×109/ L),免疫表型为CD3+、CD8+、CD4-、CD5弱表达、部分表达CD56和CD57表型、克隆性TCRγ重排,证实为CD8+T-LGL,未发现TP53突变,检测到杂合STAT3突变(第21外显子Y640 F),体检和血液生化均正常。
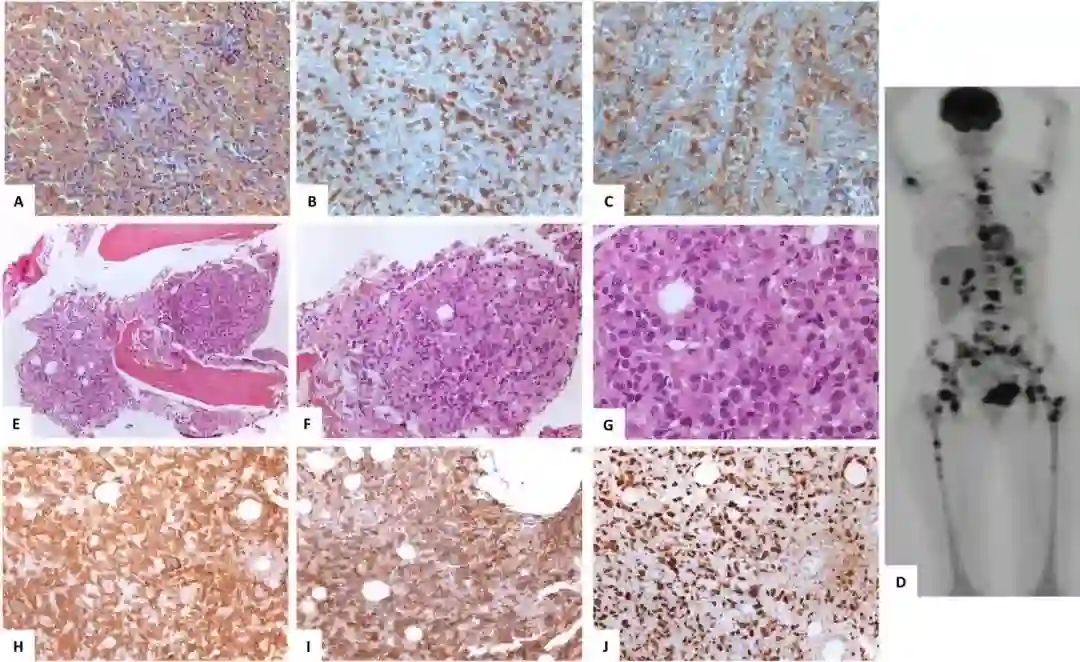
2013年,患者出现疲劳、发热、肝脾肿大和心包炎,白细胞1.9×109/L,中性粒细胞0.34×109/L,淋巴细胞0.78×109/L,血小板426×109/L,血红蛋白64g/L,存在因噬血细胞增多所致的髓内溶血性贫血,亦有弥散性血管内凝血(DIC)表现。肝脏活检显示小叶性肝炎,无淋巴细胞浸润。噬血细胞增多并非病毒感染引起。患者接受2周期依托泊苷+激素治疗,病情迅速改善,但1个月内复发,接受依托泊苷+环磷酰胺+丙种球蛋白治疗,为改善病情行脾切除和骨髓活检。病理见中等大小T淋巴细胞浸润脾窦、脾索和红髓,免疫表型CD3+、CD5+、CD8+、CD7-、TiA-1+、CD57+ (图2 A、B、C)。骨髓活检见到间质和血管内相同克隆的LGL细胞轻度浸润。
之后,患者病情再次恶化,接受依托泊苷+环磷酰胺+激素治疗,3个月后再次复发。18F-FDG-PET/CT见第三腰椎椎体、左肋骨、胸骨和髂嵴高代谢病变(图2D)。第三腰椎椎体活检见大细胞和大间变细胞广泛浸润,前者胞核不规则,胞质丰富,轻度嗜碱 (图2 E、F、G),免疫表型CD3+、CD7+、CD8+、CD 30+、TiA-1+、粒酶B+、P53+、CD2+/-、CD56+、CD57+、CD4-、CD20-、CD79a-、ALK-(图2 H、I、G),存在与之前相同的克隆性TCR重排,TP53基因分析在第5外显子检测到病理性突变P151T (VAF85%),该突变初诊时未检测到。STAT3基因分析显示,初诊时检测到的杂合子突变在疾病转化时转为纯合突变,并在BCOR发现了新的突变(p.G599fs,VAF57%)。
患者接受Brentuximab-Vedotin(BV)-CHEP(环磷酰胺、长春新碱、泼尼松和足叶乙苷)和BV-CHOEP(环磷酰胺、长春新碱、泼尼松、足叶乙苷、阿霉素)各1周期,疾病进展。由于反复发作的弥散性血管内凝血和噬血细胞增多,后改为BV-DHAX+依托泊苷+英夫利昔单抗治疗,但患者最终仍死于疾病进展。
图2 病例2细胞学、细胞遗传学和病理学分析。A. 脾切除标本可见正常结构,小和中等不典型淋巴细胞浸润脾索和脾窦。B.脾窦内CD3+细胞。C.脾内肿瘤细胞,约60%为CD8+;18F-FDG- PET/CT见多个高代谢骨损害。E、F、G: 第三腰椎活检见大细胞浸润,核不规则,胞质丰富,轻度嗜碱,亦可见大的间变细胞。H、I、J.骨活检内的肿瘤细胞免疫组化示CD3+(G)、CD8+(H),核内弥漫性强表达P53(I)
寻根溯源
T-LGL是一种惰性疾病,10年生存率约70%,少有侵袭性T-LGL病例报道。T-LGL中位诊断年龄60 岁,本文患者年龄分别为55岁和30岁,已发表病例中,发生侵袭性转化的年龄约为41岁,T-LGL性别比例1∶1,而侵袭性疾病比例为2∶1,女性易发,本文2例患者均为女性。
本文病例中,证实T-LGL克隆性演化为侵袭性淋巴瘤,是因为起源细胞的表型一致性:病例1表型为CD4+、CD8+,并不常见;病例2的CD8+细胞表达细胞毒标志粒酶B和TiA1,但本质上仍属于常见的克隆性TCRγ重排。
既往报道发生疾病转化的患者会出现B症状、淋巴结迅速增大,扁桃体和皮下脂肪组织浸润、骨髓浸润导致血细胞减少、肝脾肿大且有LGL克隆小T细胞浸润。肿瘤细胞形态与外周T细胞淋巴瘤,NOS并无明显区别,表现为大的多形性细胞,胞核不规则,染色质不成熟,核仁轮廓清晰,胞质丰富透明,可见细胞有丝分裂。本文病例与之相似。
关于转化后疾病的生物学特性,尚无分子研究报道,仅1例报告进行了细胞遗传学分析,发现为复杂细胞遗传学改变。病例1为染色体复杂核型,近四倍体,有17p缺失。研究显示,28%~75% T-LGL源自抗原刺激产生的效应记忆细胞毒T细胞,该T细胞可导致JAK-STAT3信号上调,驱动获得性STAT3突变亚克隆的选择,2%的病例存在STAT5b突变。病例1未检测到STAT3或STAT5b突变。病例2有STAT3杂合突变,疾病转化时转为纯合突变,此种进化的生物学结果并不清楚。此外,病例1在诊断时还检测到TP53基因第8外显子R282W获得性突变,导致蛋白质失活,病例2在疾病转化时检测到第5外显子P151T突变。病例1在转化为侵袭性T细胞淋巴瘤时,P53通路完全缺失。
上述突变在疾病转化中的作用尚不清楚,但可能与化疗耐药和染色体不稳定有关。病例2在转化中出现BCOR突变,已知50%缺失BCOR(第4外显子缺失)和小鼠可发生T细胞急性淋巴细胞白血病(T-ALL),提示BCOR在T细胞恶性肿瘤中的抑癌作用,BCOR突变与TP53等位基因在T-ALL发生中的协同作用已有报道。此外,在结外NK/T细胞淋巴瘤,鼻型中,BCOR是仅次于STAT3的第二常见突变基因,提示BCOR突变与JAK/STAT途径改变在淋巴瘤发病机制中的作用。
本文阐述的2例患者几乎对所有化疗方案均耐药,病例1只在甲氨蝶呤+左旋门冬酰胺酶治疗后获得缓解,这表明肿瘤存活依赖于天冬酰胺和/或谷氨酰胺代谢。所有治疗对病例2均无效,包括化疗联合BV方案,从病例2和极少的已发表的病例中,无法明确适合此类患者的一线治疗策略,而大剂量化疗和自体移植在病例1中也未取得成功。有人提出,年轻患者可采用急性T淋巴细胞白血病(T-ALL)方案诱导治疗,然后进行同种异体造血干细胞移植。CAR-T细胞免疫治疗可能更有效,但需要先确定可供治疗的靶点。此外,化合物APR-246能够恢复突变P53蛋白功能,具有治疗的合理性。
M Belhadj, D Mansour,S Kaltenbach ,et al. T-cell large granular lymphocyte leukemia transformation into aggressive T-celllymphoma: a report of two cases with molecular characterization[J]. Haematologica 2018.
41本肿瘤患者指南丛书
点击下方图片即可免费阅读
70个肿瘤相关临床试验招募患者
点击下方图片或识别图片二维码即可查看详情