【Blood】如何诊断骨髓增生异常综合征及其重叠疾病
骨髓增生异常综合征(MDS)是克隆性造血性疾病,临床表型不特异,正确诊断MDS及其重叠疾病对临床很重要,因遗传学和病理生物学差异,其预后、治疗方案以及分子易感性可能完全不同。美国Tanaka教授在《血液学》(Blood)杂志发表综述,讨论了MDS及其重叠疾病的诊断,包括骨髓增生异常/骨髓增殖性肿瘤(MDS/MPN)、再生障碍性贫血、继发性急性髓系白血病(sAML)、意义不明克隆性造血和意义不明特发性血细胞减少。
骨髓增生异常/骨髓增殖性肿瘤
在世界卫生组织(WHO)分类中,MDS/MPN不同于MDS和MPN,具有不同临床表现、遗传学和预后。与MDS相同的特征包括细胞发育异常、血细胞减少或一系/多系血细胞计数升高。然而MDS/MPN更多地携带与生长因子信号通路激活相关的基因突变、表观遗传调控基因突变或与形态异常相关的剪接因子突变。
慢性粒单核细胞白血病
慢性粒单核细胞白血病(CMML)是MDS/MPN最常见的疾病,除至少一系血细胞减少外,还有单核细胞增多,骨髓符合MDS诊断,单核细胞增多既可是相对增多(≥白细胞10%)也可是绝对增多(≥1×109/L),持续至少3个月,不符合其他髓系肿瘤标准,不存在其他单核细胞增多原因。
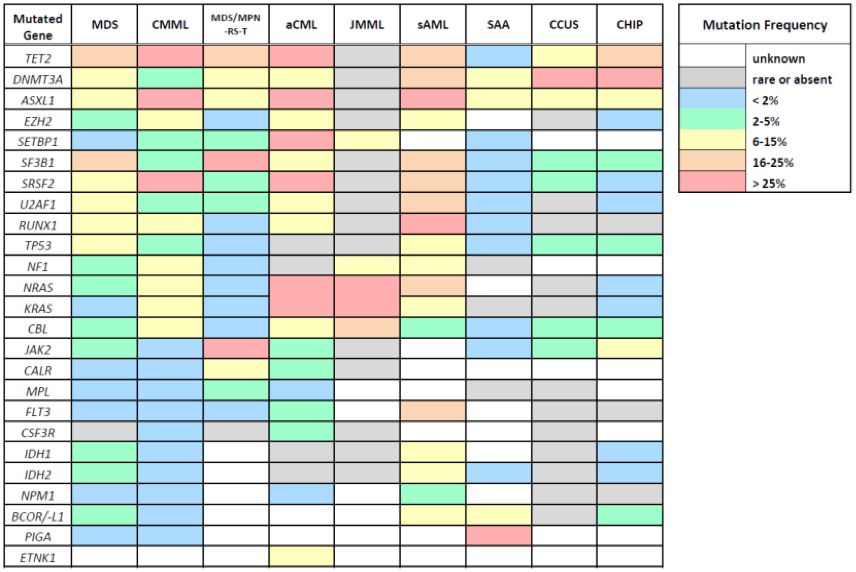
MDS和CMML的病理生物学完全不同。CMML有较高比例经典单核细胞,CD14+,CD16-,对粒细胞巨噬细胞集落刺激因子敏感,MDS不具备此特点;CMML的突变特征不同(图2),体突变如TET2、ASXL1、SRSF2、EZH2、NRAS、KRAS和CBL很常见且常同时发生,TET2、ASXL1和SRS2三联突变对诊断CMML高度特异,SF3B1和TP53突变频率低于MDS。
CMML治疗旨在改善血细胞减少或增多的相关症状,存在不良预后因素或原始细胞过多时可考虑去甲基化药物,CMML和MDS去甲基化治疗有效率和获益相似,与MDS不同,已发现CMML可预测去甲基化药物治疗反应的DNA甲基化。异基因造血干细胞移植(HSCT)是CMML唯一的治愈方法,年轻高危CMML应考虑,如采用减低强度预处理和其他供者则老年患者亦有机会进行HSCT。专家建议在HSCT前应行其他治疗,特别是骨髓原始细胞>10%或存在其他高危特征时。
MDS/MPN伴环形铁粒幼细胞和血小板增多
MDS/MPN伴环形铁粒幼细胞和血小板增多(MDS/MPN-RS-T)是另一较常见的MDS/MPN,≥15%环型铁粒幼细胞,血小板计数持续升高(≥450×109/L)。超过80%病例有SF3B1经典热点突变,常是基础突变和唯一异常。MDS/MPN-RS-T发生JAK2(50%~70%)、CALR(10%~20%)和MPL(2%~5%)的突变率也很高,与原发性血小板增多症(ET)相似。其他可能突变的基因包括TET2、DNMT3A、ASXL1和SETBP1,后2个与预后不良相关。MDS/MPN-RS-T预后介于MDS-RS-SLD和ET之间,MDS/MPN-RS-T和MDS-RS-SLD的白血病转化率相似,高于ET;MDS/MPN-RS-T与ET的血栓发生率相似,高于MDS-RS。贫血治疗遵循低风险MDS治疗,采用红细胞生成素(ESA)和输血支持治疗,小剂量阿司匹林可用于JAK2突变、年龄较大或有心血管风险因素患者。MDS/MPN-RS-T中del(5q)并不常见,来那度胺有治疗作用。细胞减灭治疗可加重贫血,不常规推荐,但有血栓形成、血管舒缩症状或获得性血管性血友病综合征多种风险因素时可实施。
非典型慢性粒细胞白血病
非典型慢性粒细胞白血病(aCML)以白细胞增多为特征,存在一定程度粒细胞生成异常,几无嗜碱性粒细胞增多(常见于CML)和单核细胞增多(CMML常见),没有与其他肿瘤相关的基因重排(如BCR-ABL1、PDGFRA、PDGFRB、FGFR1或PCM1-JAK2)。如有JAK2、CALR和MPL突变时,aCML诊断可能性降低。aCML中有<10%的病例伴有CSF3R突变,而慢性中性粒细胞白血病(CNL)中突变率为80%~90%,CNL无粒细胞生成异常。aCML并无特异的分子异常,SETBP1突变频率相对较高,达25%,CMML中6%~15%,JMML中3%,aCML中还有其他几个CMML样基因的反复再现性突变(图2)。与不能分类的MDS/MPN相比,aCML更具侵袭性。有研究报道,HSCT可使疾病长期缓解。其他常用治疗包括HMA和羟基脲细胞减灭治疗。CSF3R突变可能激活JAK/STAT通路,因此可试用JAK抑制剂治疗aCML和CNL。
幼年型粒单核细胞白血病
幼年型粒单核细胞白血病(JMML)很罕见,发生于儿童早期,中位年龄2岁,少数可自然缓解,尤其是胚系疾病如Noonan或CBL综合征,部分即便SCT后仍可复发。与CMML有共同的临床特征,如单核细胞增多和明显肝脾肿大,但遗传学特征不同于成人髓系肿瘤,几无表观遗传和剪接调节基因突变。高达95%儿童JMML携带RAS通路基因(PTPN11、NF1、NRAS、KRAS、CBL)体突变或胚系突变,有时基因突变相同,但临床结果却不相同。最近发现,DNA甲基化模式可提高对预后的预测,区分可自发缓解的JMML和侵袭性JMML。
再生障碍性贫血和低增生MDS
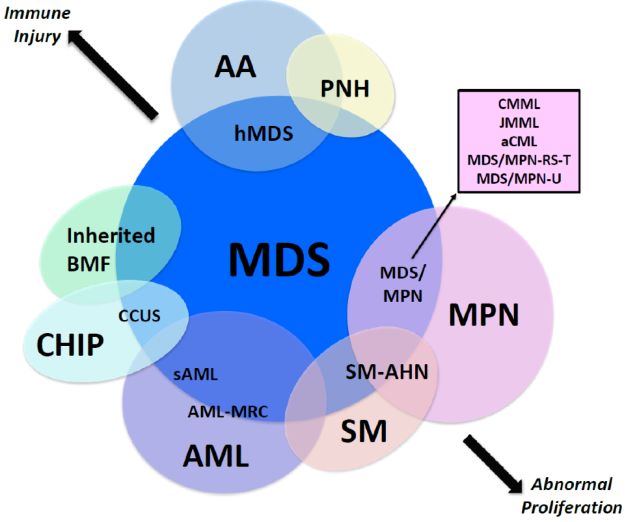
再生障碍性贫血(AA)和低增生MDS(hMDS)之间存在诊断重叠区。AA病因是免疫介导的造血干/祖细胞(HSPC)破坏,MDS是由体突变克隆性HSPC选择性生长优势驱动。2种机制可能同时发生(图1)。
图1 临床和遗传学特征与MDS相似的髓系疾病
有研究评估了150例不伴形态学异常AA患者的骨髓体突变,除PIGA突变外,29例(19%)携带突变,主要包括ASXL1、DNMT3A和BCOR(图2),17例(11%)进展为MDS,其中11例属于29例携带突变者;与无突变者相比,体突变患者的疾病持续时间更长、端粒长度更短、进展为MDS或AML的可能性更大。
另一项纳入439例AA患者的研究发现,47%存在克隆造血,DNMT3A和ASXL1突变患者的生存更差,BCOR和PIGA突变患者的IST应答率更高,携带MDS样突变的SAA更可能发生克隆扩增,特别是在IST后;其他突变包括6pHLA位点的拷贝数平衡的杂合性缺失或HLA及相关途径的突变,这些异常多发生于较年轻患者,向肿瘤进展的概率较低。
图2 与MDS诊断边界有重叠疾病的基因突变频度的差别
15%~20%的MDS骨髓为低增生,遗传学特征不同于增生性疾病,突变率较低,剪接因子基因突变频率较低,与SAA更为相似。由于骨髓细胞有限,很难通过形态发育异常区分hMDS、SAA或AA,其他支持hMDS或MDS/MPN诊断的形态学特征包括骨髓原始细胞≥2%、环形铁粒幼细胞、过度纤维化和外周假Pelger-Huet细胞。某些细胞遗传学异常,如del(5q)、单体7或倒位3被认为是MDS证据。AA缺少剪接因子和黏连蛋白基因突变,可能有助于疾病区分。缺少常见MDS突变或存在BCOR、PIGA、HLA位点异常与SAA的较好预后相关,有可能成为SAA诊断的分子标志。
实践中不要求必须区分hMDS和AA,简单认为均可能对免疫抑制治疗有反应,分子检查可用于鉴定可进展为更高风险的疾病。但需注意,许多遗传性骨髓衰竭综合征可进展为MDS或AML,如GATA2、DDX41、FA或端粒酶复合基因胚系突变,在克隆性髓系疾病之前就可能存在骨髓衰竭,这些骨髓衰竭对免疫抑制治疗无反应;注意其他家庭成员筛查;干细胞供者筛选;避免治疗的过度毒性。一些胚系易感突变,如RUNX1和ANKRD26突变,可致血小板减少和巨核细胞发育不良,此时如无其他MDS证据则不宜诊断,如同时存在体突变则肿瘤进展风险更大。新发MDS突变检测时也可能发现胚系突变,疑有胚系突变时应检测非造血组织。
克隆性造血,意义不明血细胞减少和低危MDS
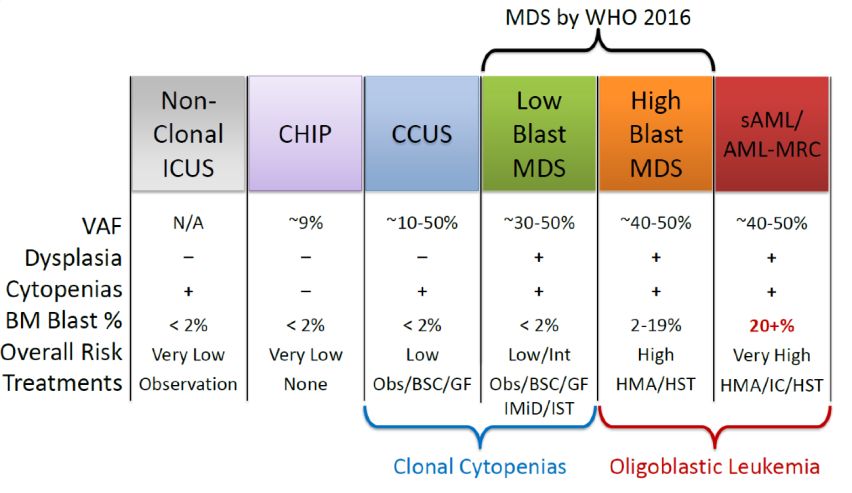
意义不明的特发性血细胞减少(ICUS)易与MDS混淆,ICUS不符合MDS骨髓标准,如原始细胞比例增高、特异的细胞遗传学异常、至少10%细胞形态异常(图3)。测序分析发现,近40% ICUS存在克隆性体突变异常,近70%存在发育异常,这些称为意义不明克隆性血细胞减少(CCUS)。CCUS与低风险MDS有许多相同的突变基因,相似的变异等位基因频率(VAF),但SF3B1突变似乎对MDS更特异。CCUS进展为MDS或其他髓系恶性肿瘤的概率较高,尤其是具有更高风险特征时,如JAK2、RUNX1体突变,剪接因子突变(SF3B1、SRSF2、U2AF1、ZRSR2),≥2个突变,5年进展风险可高达90%,DNMT3A、TET2TE或ASXL1单个突变时进展风险较低,5年进展风险约为50%。常见MDS基因若无突变,进展风险接近每年1%。
图3 与MDS有重叠的血细胞减少和克隆性造血的特征比较
典型MDS体突变也可发生于血液学正常者,随年龄增长而增加,称作意义不明克隆性造血(CHIP),患者没有血细胞减少,进展为肿瘤的风险非常低(每年约1%)。CHIP最常见突变包括DNMT3A、TET2或ASXL1(图2),低VAF(<10%)孤立病变不应诊断MDS或其他髓系肿瘤。CHIP不等同于CCUS,CCUS突变更频繁更多,向恶性疾病进展可能性更高。
MDS 进展为继发性急性髓系白血病
MDS可发展为继发性急性髓系白血病(sAML),目前定义为≥20%的骨髓和/或外周血原始细胞。有建议将MDS伴原始细胞过多和低原始细胞sAML统称为寡原始细胞白血病,明确哪些MDS将发展为白血病。Makishima等对2000余例高危MDS和sAML标本进行基因检测,sAML中NPM1、IDH1、IDH2、WT1、NRAS、PTPN11和FLT3突变频率较高,这些突变通常为亚克隆突变,与明显较短的PFS相关。MDS存在上述突变时意味着可能获得了白血病克隆,但可能在数月内并不发展为临床定义的sAML,介于MDS和sAML之间。这一假说的作用在于,针对这些亚克隆的治疗(如IDH或FLT3抑制剂)可能不会产生传统意义的血液学反应,但却可能延缓白血病转化。
基因表达模式也用来确定MDS白血病进展风险。Shiozawa等研究了MDS CD 34+骨髓细胞的转录情况,发现了两个亚组:一组富含与红细胞和巨核细胞分化(EMK)相关基因的表达,另一组富含不成熟前体细胞(IMP)基因的转录表达。EMK亚组总生存更长,与SF3B1突变、环形铁粒幼细胞和更多的红系特征相关。IMP亚组血小板计数较低、骨髓原始细胞增多、高风险突变较多。只有IMP亚组才转化为sAML,提示即使缺少白血病突变,某些MDS仍有较大进展为白血病潜能。
MDS和AML间存在另一重叠区,即之前存在未能识别的MDS,后又诊断为AML伴骨髓增生异常改变(AML-MRC),提示MDS与AML间存在病理性联系,分子检查可能有助于两者区分,并提供预后信息。AML-MRC常携带MDS相关细胞遗传学异常和典型的MDS和sAML突变基因,包括剪接因子基因(SRSF2、SF3B1和U2AF1)、染色质修饰基因(EZH2和ASXL1)及STAG2和BCOR(图2)。老年AML,即使未诊断为AML-MRC,也常携带上述基因体突变,老年新发AML不伴上述突变时,治疗反应更好,缓解时间更长。
可以认为MDS伴原始细胞增多介于低危MDS(克隆性血细胞减少伴骨髓衰竭)和寡原始细胞AML之间(图3),高危MDS或低原始细胞AML预后相似,通常HMA治疗或考虑干细胞移植。
结语
MDS及其重叠疾病是一组遗传和临床异质性疾病,代表不同的生物学领域,目前诊断标准仍较模糊,WHO疾病分类主要依赖形态学标准,而疾病分子标记物愈加有助于识别临床表型之间的差异。目前尚无特异突变可明确诊断MDS及其重叠疾病或明确界定MDS及其重叠疾病的诊断边界,将来的分类标准中必需纳入更多的分子标记物。
TANAKA T N, BEJAR R. MDS overlap disorders and diagnostic boundaries[J]. Blood,2019. DOI: https://doi.org/10.1182/blood-2018-10-844670.
41本肿瘤患者指南丛书
点击下方图片即可免费阅读
70个肿瘤相关临床试验招募患者
点击下方图片或识别图片二维码即可查看详情