【Nature子刊】南方医大梁莉组:癌症外泌体miR-25-3p诱导血管通透性和血管生成促进转移前生态位形成
转移前生态位的形成为传播肿瘤细胞提供了支持性微环境,其特征在于炎症、免疫抑制、血管生成、血管通透性、淋巴管生成、器官形成和重编程。已发现几种转移前生态位生物标志物有助于癌症诊断和预后预测。此外,靶向转移前生态位可能是干预癌症转移的有希望的策略。因此,鉴定参与转移前生态位形成的生物标志物具有重要价值,可用于癌症转移的诊断、预后和干预。
外泌体是大小为30-100 nm的小囊泡,含有蛋白质、脂质以及各种类型的核酸,包括DNA、RNA和miRNA。外泌体是引发远处器官转移前生态位形成的癌症衍生因子之一。最近,据报道癌症分泌的外泌体负责癌症诱导的远端器官中的血管通透性、炎症和骨髓祖细胞募集,这支持了转移细胞的植入和存活。最重要的是,来自癌症患者血清的外泌体已被证明是癌症诊断的可靠标志物。然而,需要进一步研究癌症来源的外泌体如何通过诱导血管生成和血管通透性来调节转移前的生态位形成。
来自南方医科大学梁莉教授课题组最新在Nature Communications杂志上发表文章,报道了癌症来源的外泌体miR-25-3p通过诱导血管通透性和血管生成来促进转移前的生态位形成。
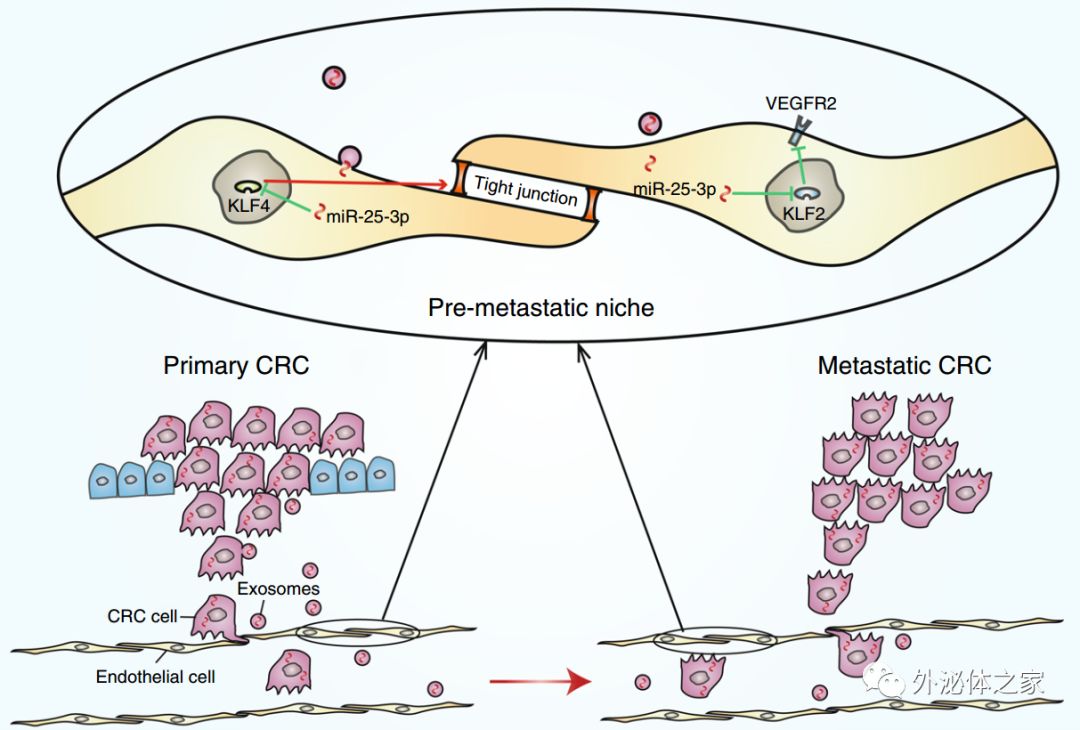
该研究发现结直肠癌(CRC)衍生的外泌体miR-25-3p可以转移至血管内皮细胞,从而通过靶向KLF2/4调节VEGFR2、ZO-1、occludin和Claudin5在内皮细胞中的表达,从而促进血管通透性和血管生成。此外,证明外泌体miR-25-3p通过诱导血管渗漏介导在裸鼠中形成转移前的生态位,从而促进CRC肝和肺转移。最后,临床数据表明来自CRC患者的循环外泌体的miR-25-3p可以用作基于血液的生物标志物用于预测转移。
CRC外泌体miR-25-3p在转移前生态位形成中的作用示意图
miRNA可以在癌细胞和基质细胞之间转移,这可有效沉默mRNA以重编程靶细胞转录组。例如,源自肝癌细胞的外泌体miR-1247-3p可以被递送至癌症相关的成纤维细胞,并促进癌症相关的成纤维细胞活化,从而促进肝细胞癌转移。外泌体介导的miR-19a从星形胶质细胞转移到肿瘤细胞,阻碍了PTEN表达,进而导致脑内侵袭性生长。总之,这些研究表明,外泌体介导的癌细胞和基质细胞之间miRNA的转移对癌症进展至关重要。该研究的FISH结果显示,CRC细胞和内皮细胞中的miR-25-3p水平呈正相关,基于此提出了miR-25-3p可通过外泌体从CRC细胞转移至内皮细胞的假设。此外,SW480细胞用Cy3标记的miR-25-3p转染,在SW480细胞外泌体一起孵育的HUVEC中观察到Cy3荧光。这些结果揭示了CRC分泌的miR-25-3p可以转移到内皮细胞。
尽管一些研究证实了转移前转移生态位在CRC转移中的重要作用,但原发性CRC细胞诱导转移前生态位形成的机制在很大程度上是未知的。此外,多项研究揭示了转移前生态位生物标志物在诊断、癌症转移干预和预后预测方面的新兴作用。值得注意的是,癌症诱导的血管通透性/血管生成是转移前生态位的特征之一。来自乳腺癌的外泌体miR-105和181c在早期转移前阶段破坏远端器官中的血管内皮屏障或血脑屏障,促进血管通透性和乳腺癌转移。
在本研究中,探讨了外泌体miR-25-3p是否调节转移前的生态位形成。体内渗透性测定显示来自CRC细胞的外泌体miR-25-3p显著促进小鼠的血管通透性。此外,来自CRC细胞的外泌体miR-25-3p降低了KLF2、KLF4、ZO-1、occludin、Claudin5的水平,并且增加了小鼠肺和肝中VEGFR2的水平。此外,在用SW480/miR-25-3p外泌体预处理的小鼠的肺和肝中观察到转移负荷的增加。CRC细胞中miR-25-3p的上调促进了血管通透性、血管生成和转移。因此,CRC分泌的miR-25-3p通过促进血管生成和破坏静脉内皮细胞的紧密连接而诱导在外部位点形成转移前的生态位。最近的一项研究揭示了KLF4通过调节血管周皮细胞激活来抑制转移前的生态位形成和转移的关键作用。然而,该数据显示,miR-25-3p的靶基因KLF4的下调导致血管内皮屏障破坏,这促进了转移前的生态位形成。总之,该研究提出KLF4在癌症诱导的转移前生态位形成中的新作用,并提供对转移前生态位形成的新见解。炎症、纤连蛋白沉积和周皮细胞的变化被认为是转移前的生态位的关键特征。然而,该结果表明,外泌体miR-25-3p既不调节S100、纤连蛋白表达也不调节肝脏和肺中的周皮细胞覆盖,表明miR-25-3p诱导的转移前生态位形成不依赖于炎症、纤连蛋白沉积和周皮细胞覆盖。靶向转移前生态位的癌症疗法被认为是干预癌症转移的有希望的策略。靶向骨髓细胞中的S1PR1-STAT3信号通路抑制转移前的生态位形成和癌症转移。抑制血管生成素-2可抑制癌症诱导的转移灶中内皮细胞的炎症和血管生成反应。该研究结果显示,阻断来自CRC细胞的外泌体miR-25-3p减轻了肝和肺血管通透性以及随后的CRC转移,表明miR-25-3p可以用作干预CRC转移的治疗靶标。
最近的研究揭示了外泌体生物标志物在癌症诊断和预后评估中的新兴作用。来自胰腺导管腺癌细胞(PDAC)的外泌体巨噬细胞迁移抑制因子有助于肝脏转移前的生态位形成,可用于诊断PDAC肝转移。证实外泌体整合素是器官特异性转移预测的潜在标志物。据报道,来自脂肪肉瘤细胞的外泌体miR-25-3p通过诱导支持性微环境的形成促进脂肪肉瘤的进展,并且它可以用作脂肪肉瘤预测的预后和治疗效果的循环标记。该研究的数据显示转移的CRC患者的循环外泌体中的miR-25-3p水平高于没有转移的CRC患者。此外,在接受切除手术的大多数CRC患者中观察到miR-25-3p水平的显著下降。还发现CRC患者的循环外泌体和癌组织之间的miR-25-3p水平呈正相关。总的来说,这些临床数据表明,循环外泌体中miR-25-3p水平的定量血液检测可用于诊断CRC转移,并为具有高转移风险的患者选择预防性治疗提供参考信息。
有关外泌体促进转移前生态位形成的文章,给大家推荐几篇:
Costa-Silva, B., etal. (2015). "Pancreatic cancer exosomes initiate pre-metastatic niche formation in the liver." Nat Cell Biol. 外泌体领域大牛David Lyden 的一篇文章。该研究发现发现胰腺导管腺癌 (PDACs)来源的外泌体诱导肝脏中转移前微环境的形成,从而增加了肝脏转移性负担。
Liu, Y., et al.(2016). "Tumor Exosomal RNAs Promote Lung Pre-metastatic Niche Formation by Activating Alveolar Epithelial TLR3 to Recruit Neutrophils." Cancer Cell 30(2): 243-256. 这是曹雪涛研究团队发表的一篇文章。该研究发现,肺上皮细胞是中性粒细胞募集和肺转移利基形成的关键位置,这是通过肿瘤外泌体RNA和Toll样受体3(TLR3)实现的。
Peinado, H., et al.(2017). "Pre-metastatic niches: organ-specific homes for metastases."Nat Rev Cancer. 一篇Nature Reviews系列综述。
参考文献:
ZhichengZeng, Yuling Li, Yangjian Pan, Xiaoliang Lan, Fuyao Song, Jingbo Sun, Kun Zhou,Xiaolong Liu, Xiaoli Ren, Feifei Wang, Jinlong Hu, Xiaohui Zhu, Wei Yang,Wenting Liao, Guoxin Li, Yanqing Ding & Li Liang. Cancer-derived exosomal miR-25-3p promotes pre-metastatic niche formation by inducing vascular permeability and angiogenesis. Nature Communications |(2018) 9:5395 | https://doi.org/10.1038/s41467-018-07810-w
科研学习班了解一下~ ~(点击详细了解):
回复“外泌体” 阅读外泌体最新科研进展及动态
回复“EV” 阅读 2016-2018年This Week in Extracellular Vesicles
回复“盘点” 阅读 外泌体领域十大前沿进展盘点