上海交大余辉课题组在PNAS上提出外泌体成像分析新技术
外泌体是液体活检癌症筛查技术的重要研究对象之一,对基础研究和临床应用领域都具有重要的意义。然而,外泌体的粒径范围为30~150纳米,传统的光学显微镜无法对其进行直接观察,限制了对外泌体的广泛深入的研究。近日,上海交通大学个性化医学研究院(IPM)余辉课题组在国际顶尖期刊《美国科学院院刊》(PNAS)发表题为“Interferometric plasmonic imaging and detection of single exosomes”的文章,介绍了在外泌体成像分析技术方面的新成果。该研究提供了一种在单颗粒尺度对外泌体进行动态观察和定量分析的新型成像技术,能对外泌体进行粒径、表面分子标记物、运动轨迹等信息进行检测分析,该技术被命名为干涉等离子体显微技术(interferometric plasmonic microscopy, iPM)。
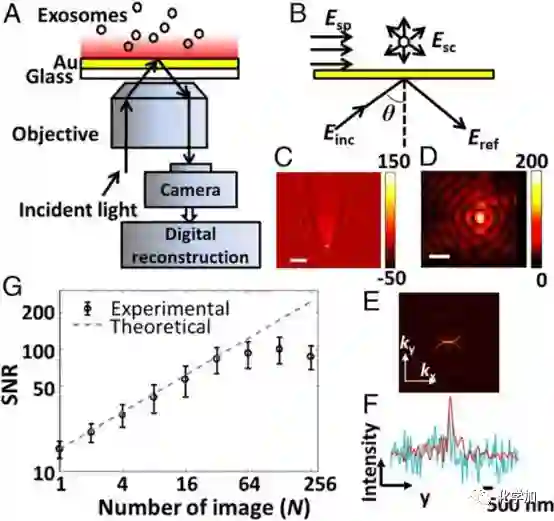
iPM技术的前身是表面等离子体共振显微技术(SPRM),其差别在于优化的实验方法及图像分析技术。iPM是在课题组提出的单分子散射干涉成像模型的基础上,采用了调整入射角、图像采集速率、时域和空间域滤波,以及复频域反卷积等技术(图1),提高单个纳米颗粒成像的检测限至30纳米,以及定量分析粒径的能力,满足对外泌体单颗粒成像的需求。
图1. iPM技术示意图。(A)基本结构;(B)单分子散射干涉成像原理示意图;(C)SPRM和(D)iPM的单个纳米颗粒图像,及(F)信号强度对比;(E)单个纳米颗粒的SPRM空间域图像;时域平均技术提高系统信噪比。
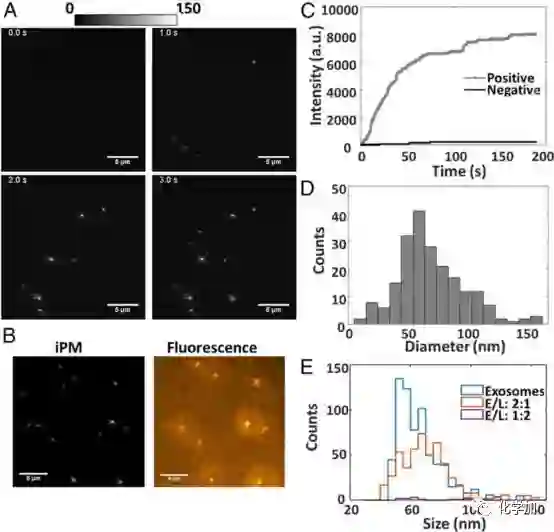
通过对芯片表面进行电荷修饰,iPM能实时免标记地记录外泌体在芯片表面的贴覆过程(图2),并以此分析外泌体样品的粒径分布;同时该技术还能有效分析外泌体与脂质体的融合前后的粒径分布变化,为其定量分析提供了一种新的技术手段。
图2. iPM检测外泌体。(A)iPM检测外泌体贴覆过程;(B)iPM与荧光图像对比;(C)动态贴覆过程曲线;(D)粒径分析;(E)外泌体/脂质体融合分析
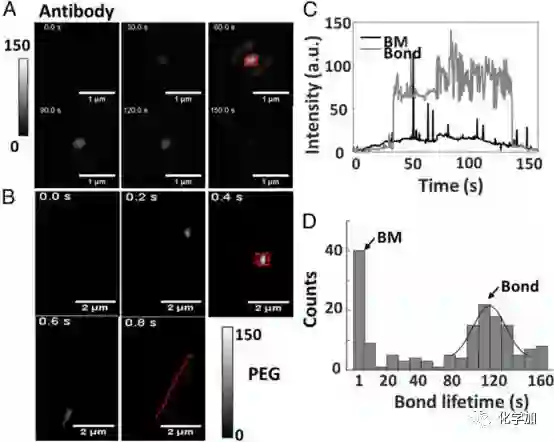
论文还对外泌体单颗粒在CD63抗体修饰金表面的行为进行了记录和追踪,观察到不同于在电荷修饰表面的独特的hit-stay-run行为(图3),并分析了其停留时间以及运动速度等参数,有望作为分析外泌体和抗体间结合力的手段。
图3. iPM记录外泌体-抗体相互作用。(A)外泌体与抗体结合过程记录;(B)布朗运动轨迹;(C)外泌体在抗体修饰表面的iPM信号;(D)停留时间分析
论文的第一作者为余辉教授课题组博士后杨玉婷,上海交通大学丁显廷教授为论文的共同通讯作者;论文其他作者还包括副研究员沈广霞,博士生李红霞、张婷以及美国亚利桑那州立大学(南京大学)陶农建教授及其课题组博士后王晖。余辉教授(ipmyu.sjtu.edu.cn)2017年加入上海交通大学个性化医学研究院任特别研究员,其主要研究方向为生物光学成像检测技术与生物传感器。
论文链接:https://doi.org/10.1073/pnas.1804548115
科研学习班了解一下~ ~(点击详细了解):
不做实验,不写meta分析,用这个方法轻轻松松发多篇SCI论文
回复“外泌体” 阅读外泌体最新科研进展及动态
回复“EV” 阅读 2016-2018年This Week in Extracellular Vesicles
回复“盘点” 阅读 外泌体领域十大前沿进展盘点