浙江大学教授JCS发现保障受精卵第一次DNA复制顺利完成的关键因子
哺乳动物的卵母细胞在胚胎期形成以后,就停止了 DNA 复制,进入长达几十年的细胞周期阻滞。而受精是个体生命的起点,受精以后短时间内雌雄原核中的 DNA 重新启动复制,并且伴随着剧烈的基因组重编程和表观遗传修饰的改变。因此,受精卵的第一次细胞分裂与体细胞的普通细胞周期相比,具有非常多的独特之处。是哪些分子以什么机制参与调控受精卵细胞周期进程,从而开启新生命的发育程序呢?目前已有的研究还是冰山一角。
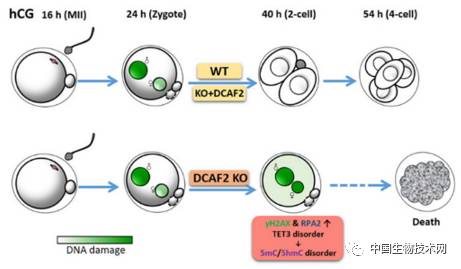
范衡宇实验室发现,CRL4 泛素连接酶的一个底物识别蛋白 DCAF2(也叫 CDT2 或 DTL)在小鼠卵母细胞和受精卵中高表达。DCAF2 在体外培养细胞系中的已知功能是在 DNA 复制过程中抑制重复复制、维持基因组稳定,但是 DCAF2 在体内生长发育的哺乳动物细胞中具有怎样的生理功能目前还没有研究。特别是,Dcaf2 基因敲除小鼠胚胎在 8 细胞期即死亡,因此阻碍了人们详细研究 DCAF2 在体内细胞发育过程中的功能。
于是,范衡宇实验室制作了 Dcaf2 LoxP 小鼠,并与 Gdf9-Cre 工具小鼠杂交,得到了卵母细胞特异性 Dcaf2 条件基因敲除小鼠。与体细胞不同,敲除 Dcaf2 对卵母细胞的存活、生长和减数分裂细胞周期进程并没有影响。但是,这些缺失母源性 Dcaf2 的卵母细胞受精以后,虽然能够形成雌雄原核,但不能发生卵裂,阻滞在一细胞期,从而造成雌性完全不育。进一步机制研究发现,母源性 Dcaf2 敲除以后,造成 DNA 复制启始因子 CDT1 过度积累,受精卵可以启动但是不能终止第一次基因组复制,从而使受精卵积累了大量 DNA 损伤,无法完成细胞周期的 G2/ M 转换。另外,这种基因组不稳定性也造成了表观遗传修饰,比如 DNA 五羟甲基化的紊乱,影响了受精卵基因组重构。
图:母源性 DCAF2 在受精卵基因组稳定性维持中的功能示意图
该研究首次证明 DCAF2 是保障受精卵第一次 DNA 复制顺利完成的母源性因子,也首次研究了 DCAF2 在哺乳动物体内特定细胞类型(卵母细胞)中的生理功能,进一步阐明了 CRL4 泛素连接酶维持正常雌性生殖过程的分子机制。相关结果发表在 Journal of Cell Science 上。范衡宇实验室博士研究生徐一文为本文第一作者。JCS 杂志也对徐一文进行了专访,专访内容将发表在 JCS 杂志网站的“第一作者访谈”专栏。
来源:浙江大学生命科学研究院
中国生物技术网诚邀生物领域科学家在我们的平台上,发表和介绍国内外原创的科研成果。
注:国内为原创研究成果或评论、综述,国际为在线发表一个月内的最新成果或综述,字数500字以上,并请提供至少一张图片。投稿者,请将文章发送至weixin@im.ac.cn。
本公众号由中国科学院微生物研究所信息中心承办
微信公众号:中国生物技术网 回复关键词“热点”可阅读热点专题文章,包括“施一公”、“肠道菌群”、“肿瘤”、“免疫”和“健康”