武汉病毒所建立研究活细胞内蛋白质互作的新方法
近日,中国科学院武汉病毒研究所/病毒学国家重点实验室胡志红、王曼丽研究团队在蛋白质相互作用的研究方法方面取得新进展,相关研究成果以Mito-docking: A novel in vivo method to detect protein-protein interactions(《线粒体锚定:一种研究活细胞内蛋白间相互作用的新方法》)为题发表在国际学术期刊Small Methods上。
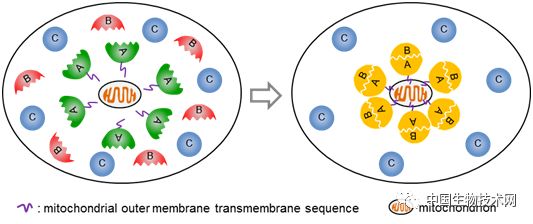
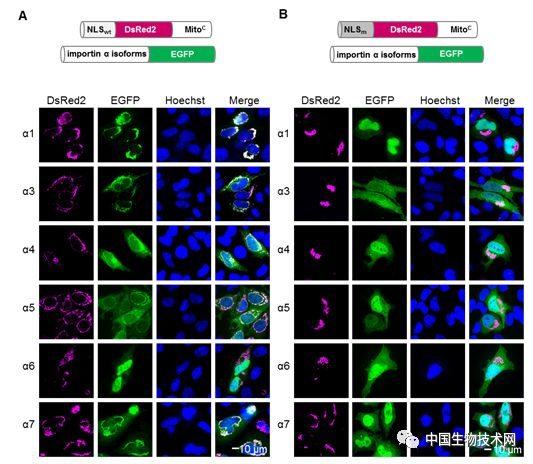
蛋白质之间的相互作用对生命活动至关重要。尽管已有不少体内研究蛋白互作的方法,但由于许多蛋白互作是高度动态的,因此用传统的方法难以捕获。该研究基于“招募”和“聚集”的原理,即将“诱饵”蛋白A锚定在线粒体的外膜上,如B蛋白能与A蛋白互作,则将被“捕获”到线粒体外膜,发生富集;如C蛋白不与A蛋白互作,则不会发生定位变化(图1)。文章首先用线粒体锚定(Mito-docking)的方法有效验证了G蛋白亚基γ2和β1间的互作,并进一步运用该方法研究了核转运受体(importin α isoforms)与货物蛋白(经典的核定位信号cNLS)之间的互作,揭示了核转运受体-货物蛋白的识别特异性(图2)。
研究发现,该方法不仅能有效检测如核运输过程中的短暂蛋白间互作,还能对蛋白互作的强度进行相对定量分析,是一种高效、直观、简单的研究活细胞中蛋白质互作的新方法。
武汉病毒所博士生邵伟为该论文的第一作者,副研究员王曼丽和研究员胡志红是该论文的共同通讯作者。该研究得到中科院前沿科学重点研究项目(QYZDJ-SSW-SMC021)、国家自然科学基金创新研究群体项目(31621061)和病毒学国家重点实验室病毒学前沿科学重点研究项目(klv-2016-03)的资助。
图1. Mito-docking研究蛋白间相互作用的原理示意图
图2. 利用Mito-docking研究importin α异构体对SV40 NLS的识别特异性。A. 将含有线粒体锚定信号的野生型NLS(NLSwt)与不同的importin α异构体共转染细胞。发现除α6外,其余几个importin α异构体均被招募到线粒体外膜,从而产生明显的荧光共定位现象。B. NLS突变后(NLSm)不能与任何importin α异构体互作。
中国生物技术网诚邀生物领域科学家在我们的平台上,发表和介绍国内外原创的科研成果。
注:国内为原创研究成果或评论、综述,国际为在线发表一个月内的最新成果或综述,字数500字以上,并请提供至少一张图片。投稿者,请将文章发送至weixin@im.ac.cn。
本公众号由中国科学院微生物研究所信息中心承办
微信公众号:中国生物技术网 回复关键词“热点”可阅读热点专题文章,包括“施一公”、“肠道菌群”、“肿瘤”、“免疫”和“健康”