【NCB】乳腺癌模型中化疗引发细胞外囊泡促进癌症转移
新辅助化疗为浸润性乳腺癌的患者提供长期临床益处,特别是当原发肿瘤在手术前完全消退时。然而,新辅助化疗的治疗益处可能受到某些细胞毒性药物诱导的肿瘤促宿主反应的限制。一些报道已经记录了细胞毒性剂在小鼠乳腺肿瘤模型中的转移前效应。例如,紫杉醇(PTX),一种常用于乳腺癌治疗的微管稳定药物,据报道可增强肺内皮细胞上血管-内皮生长因子受体1的表达,促进癌细胞粘附和随后的转移。PTX和多柔比星(DOX)-蒽环素也用于乳腺癌治疗,增加了血管周围TIE2+巨噬细胞在原发性乳腺肿瘤中促进癌细胞内渗入的能力,从而导致肺转移加重。总体而言,小鼠模型中的临床前数据表明,某些化学疗法的促转移能力可能涉及促进原发性肿瘤中的癌细胞内渗和二次转移部位的外渗。
原发性肿瘤释放细胞外囊泡(EV),可调节远处器官niches的生物学以增强转移性癌细胞的接种和生长。来自瑞士的研究人员近期在Nature Cell Biology杂志上发表文章,研究了PTX和DOX对化学耐药乳腺癌小鼠模型中肿瘤来源EV的释放、性质和转移潜能的影响。
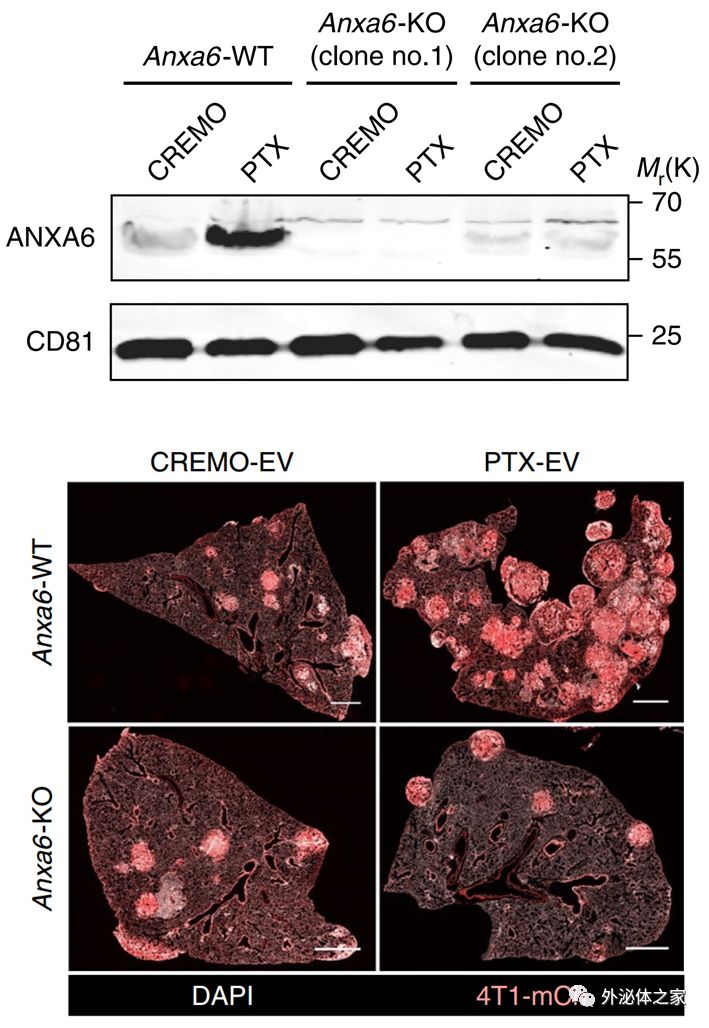
原发性肿瘤释放细胞外囊泡(EV),包括外泌体,可促进远处器官中转移性癌细胞的接种和生长,但化疗对肿瘤来源的EV的影响仍不清楚。该研究显示广泛用于术前(新辅助)乳腺癌治疗,紫杉烷和蒽环类药物的两类细胞毒性药物,引发肿瘤释放具有增强转移能力的EV。化疗引发的EV富含膜联蛋白A6(ANXA6),一种Ca2+依赖性蛋白,促进NF-κB依赖性内皮细胞活化,Ccl2诱导和Ly6C+CCR2+单核细胞在肺转移前生态位扩增,促进肺转移。癌细胞中的ANXA6或宿主细胞中的Ccr2的遗传失活减弱了化疗诱发的EV的转移前效应。ANXA6在接受新辅助化疗的乳腺癌患者的循环EV中被检测到并且可能富集。
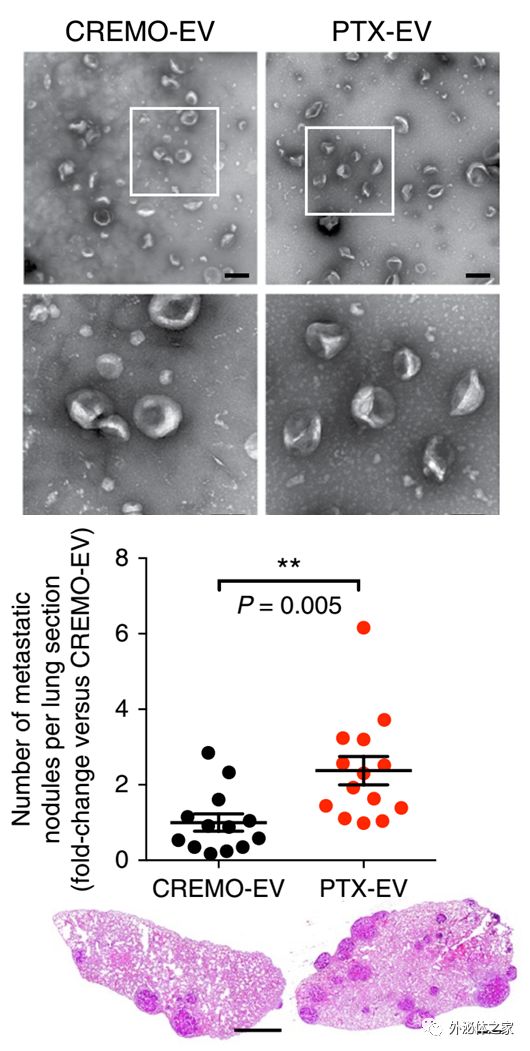
化疗引发的EV在小鼠肿瘤模型中促进肿瘤转移
新辅助化疗通过诱导病理性完全反应来改善浸润性乳腺癌的治疗,这种反应与一小部分患者的复发风险显著降低有关。然而,治疗诱导的宿主反应,可能会限制某些患者术前治疗的益处。很容易推测人类原发性乳腺肿瘤在新辅助化疗(部分或完全化学抗性)的情况下不易消退,也可能释放促转移性EV,从而通过化学抗性促进转移癌细胞的接种、存活或早期定植。然而,该报道没有研究与各种治疗相关的小鼠的存活率,因此忽略了在化学诱发的EV中响应的转移性播种和生长增加是否会转化为实验性癌症模型中较短的存活率。
PTX促进EV-ANXA6上调,进而促进乳腺肿瘤转移
目前对肿瘤来源的EV在人乳腺癌转移过程中的潜在参与知之甚少,并且鉴于缺乏已验证的乳腺癌特异性EV标记,可能难以探索。在未来,化疗诱发的EV可能提供生物标志物,用于预测未达到完全反应的患者的新辅助化疗相关的转移风险。有趣的是,在从MDA-MB-231衍生的克隆4175分离的EV中检测到ANXA6,其表现出肺转倾向性。此外,EV相关的ANXA6与小鼠模型中的胰腺癌的进展有关。因此,EV相关ANXA6对乳腺癌转移的重要性值得进一步研究。
参考文献:Keklikoglou,I., et al.. "Chemotherapy elicits pro-metastatic extracellular vesicles in breast cancer models." Nature Cell Biology. Epub2018 Dec 31 DOI:10.1038/s41556-018-0256-3
科研学习班了解一下~ ~(点击详细了解):
国家自然科学基金撰写申报经验分享会(2019/1/12-13)
临床数据预测模型类论文专题研讨会(2019/1/12-13 北京)
北京线下班|科研图像处理与作图排版(2019年1月12-13)
系统评价与meta分析(2019.1.10-13 上海)临床科研设计和数据管理学习班 (2019.1.15-17上海 )
不做实验,不写meta分析,用这个方法轻轻松松发多篇SCI论文(2019年1月5-6日 广州)
肠道菌群国自然课题设计及研究策略专题会议(2019/1/5-6 上海)
肠道菌与代谢课题设计与2019国自然申请专题辅导班(广州 2019年1月12-13日;上海班:2019年1月19-20日)
回复“外泌体” 阅读外泌体最新科研进展及动态
回复“EV” 阅读 2016-2018年This Week in Extracellular Vesicles
回复“盘点” 阅读 外泌体领域十大前沿进展盘点