使用深度学习,通过一个片段修饰进行分子优化

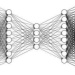
图示:Modof 模型概述。(来源:论文)
-
它一次修改一个片段。它更好地接近体外化学修饰并保留了大部分分子支架。因此,它可能更好地告知和指导体外分子优化。 -
它只对需要修改的片段进行编码和解码,有利于更好的修改性能。 -
Modof-pipe 迭代地修改不同断开站点的多个片段。它可以更轻松地控制和直观地破译中间修改步骤,并有助于更好地解释整个修改过程。 -
Modof 没有最先进的技术那么复杂。它的参数至少减少了 40%,使用的训练数据减少了 26%。 -
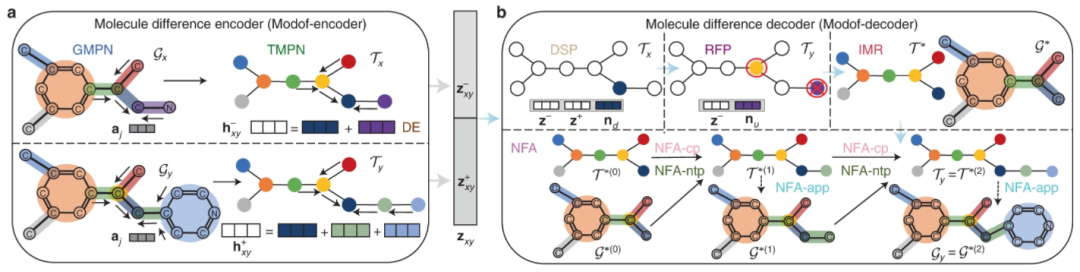
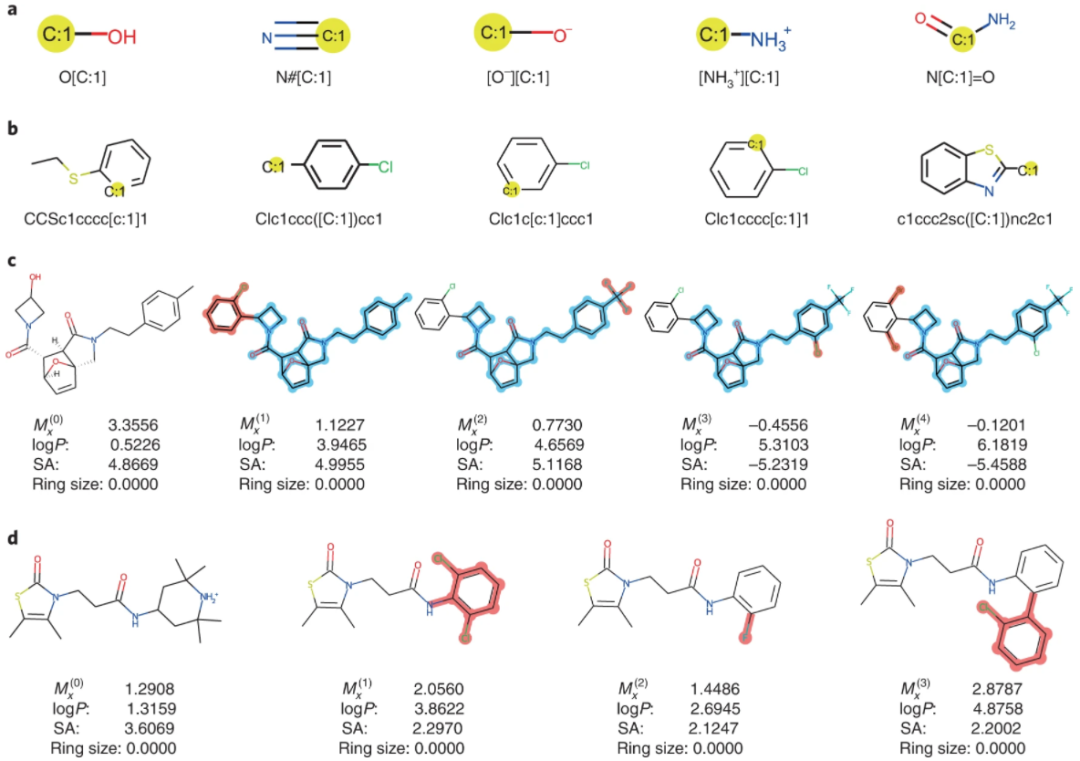
Modof-pipe 在优化辛醇-水分配系数方面优于基准数据集上的最先进方法,该系数受到合成可及性 (SA) 和环尺寸的影响,在优化分子没有分子相似性约束的情况下提高了 81.2%,而优化了 51.2 %、25.6% 和 9.2% 的改进,如果优化后的分子需要至少与优化前的分子相似,分别为 0.2、0.4 和 0.6。 -
Modof-pipem 将 Modof-pipe 的性能提高了至少 17.8%。 -
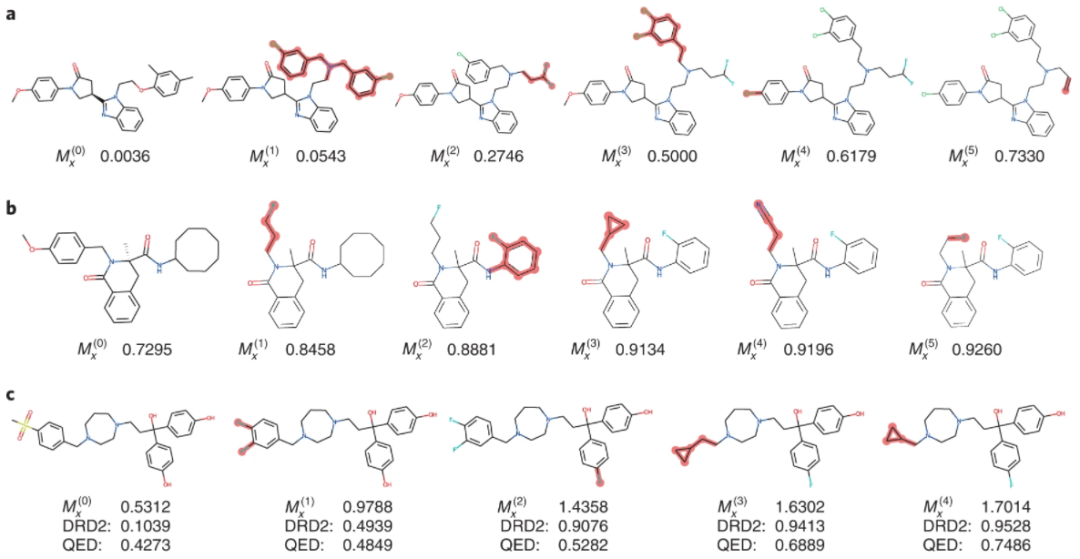
Modof-pipem 和 Modof-pipe 在其他两项基准测试任务中也表现出卓越的性能,优化分子对多巴胺 D2 受体的结合亲和力并改善通过定量测量估计的药物相似性。
登录查看更多
相关内容
Arxiv
0+阅读 · 2022年4月20日
Arxiv
1+阅读 · 2022年4月19日
Arxiv
1+阅读 · 2022年4月18日
Arxiv
0+阅读 · 2022年4月15日