1、结构上专门为ALK设计的靶向药物,更加精准
【2018 CSCO】Alectinib引领ALK阳性晚期NSCLC进入慢病管理新时代
2018年9月20日,第二十一届全国临床肿瘤学大会暨2018年CSCO学术年会期间,罗氏举办了“愈见34.8 遇见安圣莎”卫星会(Alectinib),由吴一龙教授与周彩存教授共同担任本次卫星会主席,多位肺癌领域知名专家共同探讨安圣莎的ALEX临床研究给ALK阳性肺癌患者的治疗所带来的巨大变革。
靶向治疗作为抗肿瘤治疗热点中的热点,在经过了多年的瓶颈之后,终于通过安圣莎的ALEX研究攀上了新的高峰。作为第二个获批的二代ALK抑制剂,安圣莎以全面的优势重新谱写了ALK阳性非小细胞肺癌的治疗策略。罗氏公司在大会9月20日中午特设“愈见34.8 遇见安圣莎”卫星会,国内学界大咖观点碰撞,ALK抑制剂治疗肺癌火力全开。卫星会特别邀请到吴一龙教授、周彩存教授、王洁教授、宋勇教授等共同探讨ALK阳性非小细胞肺癌治疗的新风向和新标准,为大家呈现了一场精彩的学术会议。
宋勇教授:不一样的时代-Alectinib开启ALK+非小细胞肺癌一线治疗新篇章
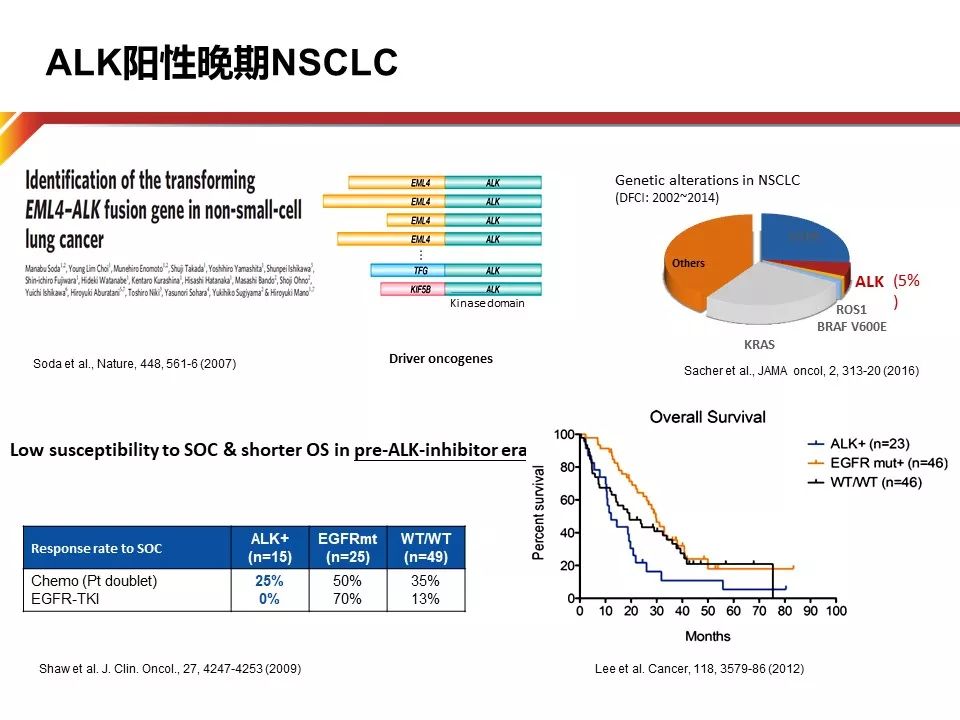
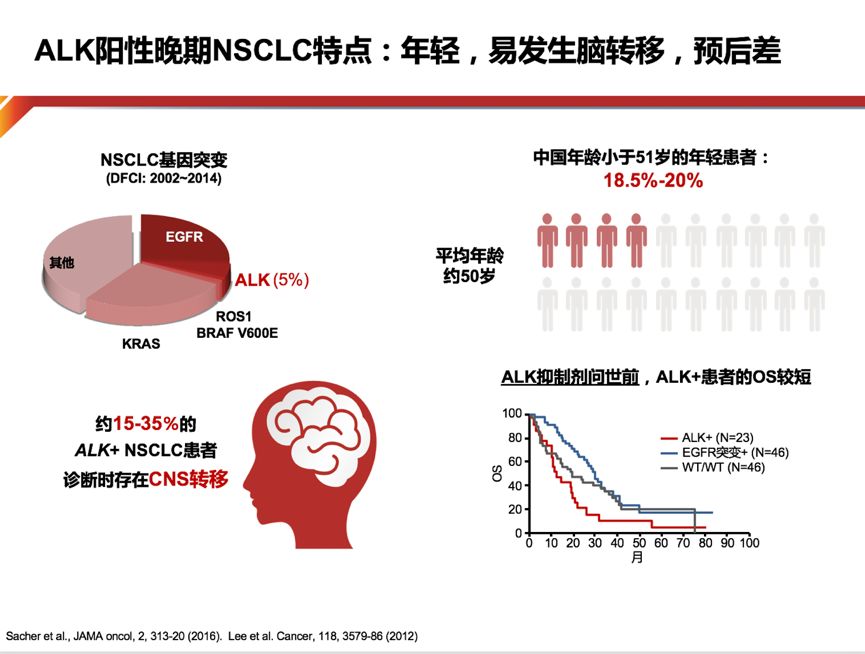
ALK阳性非小细胞肺癌患者是非常特别的群体,由于成瘤性非常强,因此早在ALK抑制剂尚未出现之时,患者的生存时间可被分为三组,而ALK阳性患者生存最为短暂。
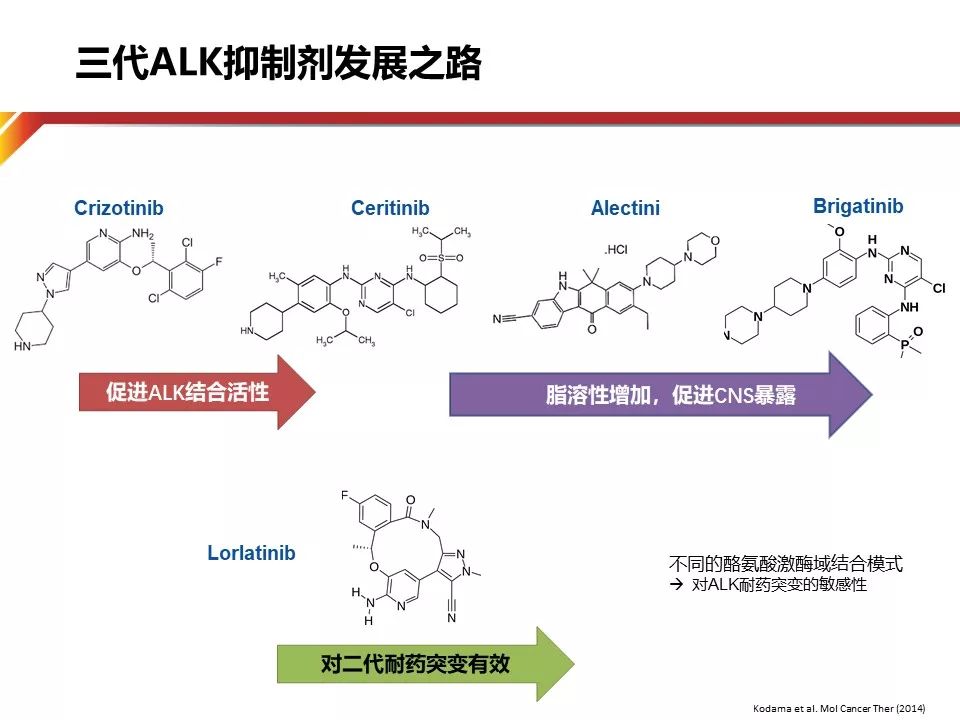
ALK阳性约占非小细胞肺癌(NSCLC)的5%左右,东西方的人群分布并不像EGFR突变存在差异。翻开ALK通路的发展史,大家会发现一个非常丰富的历程,非常多的药物研发。导致这一现象的原因可能有以下三点:1.较差的生存对于ALK抑制剂的诉求;2.高发的脑转移耐药;3.有待提高的药物安全性。因此靶向的专一程度、提高血脑通过率以及对于ALK激酶域耐药突变的抑制性,成为新的ALK抑制剂追逐的方向。三代ALK抑制剂特征如下:第一代代表药物Crizotinib,其最大的优势是促进ALK的结合活性,其PFS及OS均被证实优于化疗;第二代ALK抑制剂的脂溶性增加,并因此在脑脊液中获得更高的药物浓度,增加了中枢神经系统的药物疗效;第三代ALK抑制剂则针对二代药物耐药后的患者仍然有非常好的治疗作用。
目前NCCN指南推荐ALK阳性一线治疗的三个药物,从药物特征来看,Crizotinib与Ceritinib均具有包含ALK及ROS1在内的多靶点活性,而Alectinib则是一个专一的Alk抑制剂,因为专一,所以高效。此外,Alectinib是第一个与一代ALK-TKI进行头对头对比的III期临床研究的药物。凭借出色的疗效和安全性,NCCN在推荐Alectinib一线治疗ALK阳性NSCLC时,第一次加入“preferred”,确定了Alectinib的一线优选地位。
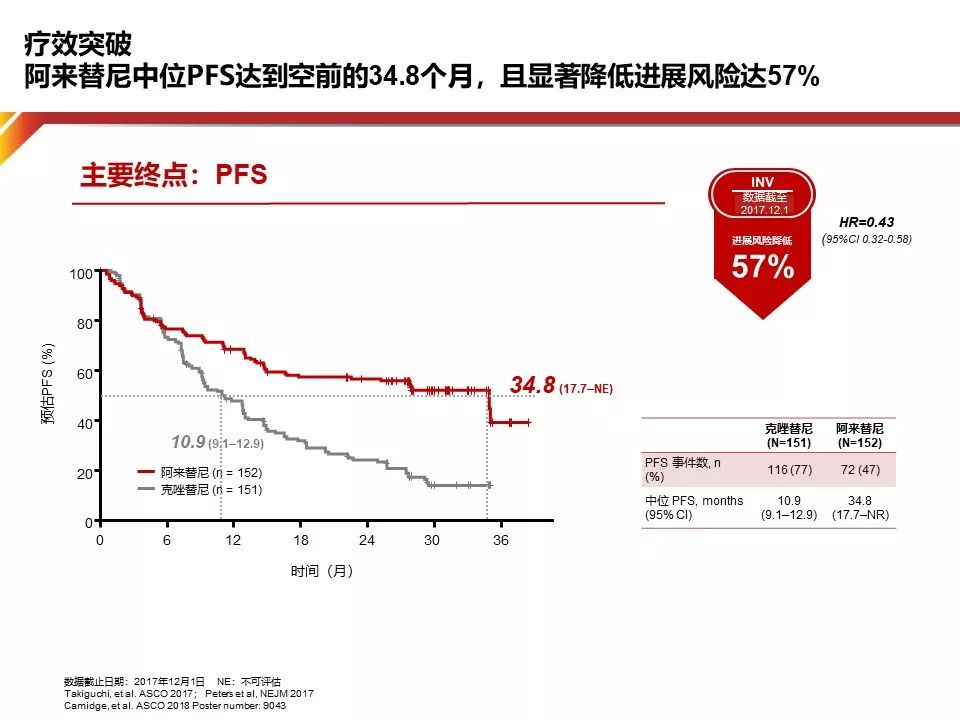
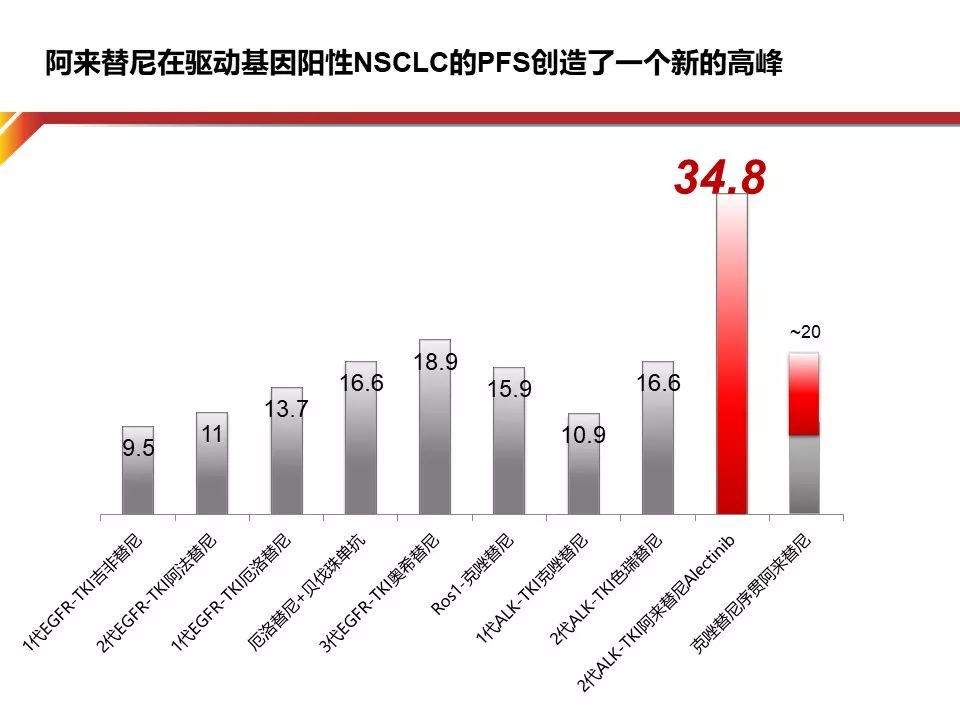
从临床研究的时间线看起,我们在临床中一直寻找给予ALK阳性NSCLC患者更高效、安全的治疗药物,由此Alectinib闪亮登场。今年ASCO上报告了研究者评估的PFS空前的34.8个月对比Crizotinib的11个月。此外,Alectinib用于一线的进展风险比Crizotinib下降了57%。
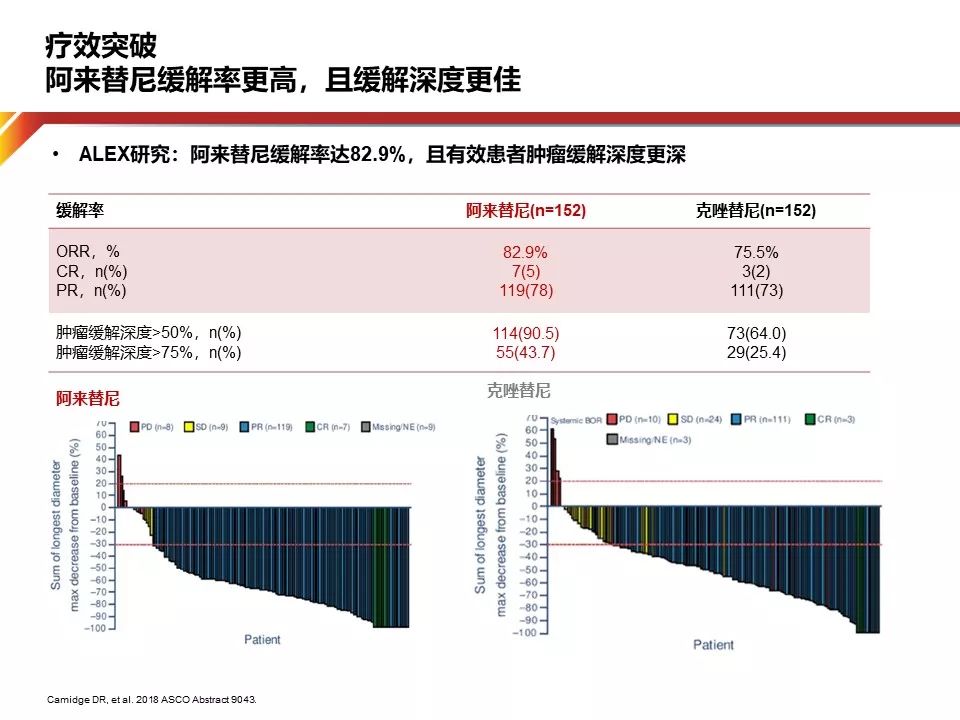
为什么这两个药物差异如此巨大?仔细观察这个研究,我们会发现这两个药物的有效率相差仅仅7%。如此长的PFS可能来自Alectinib对于肿瘤深度缓解。可以发现,Alectinib治疗组90%以上的患者都可以达到肿瘤缓解50%,而对照组仅有64%。这可能是导致PFS差异的重要原因之一。
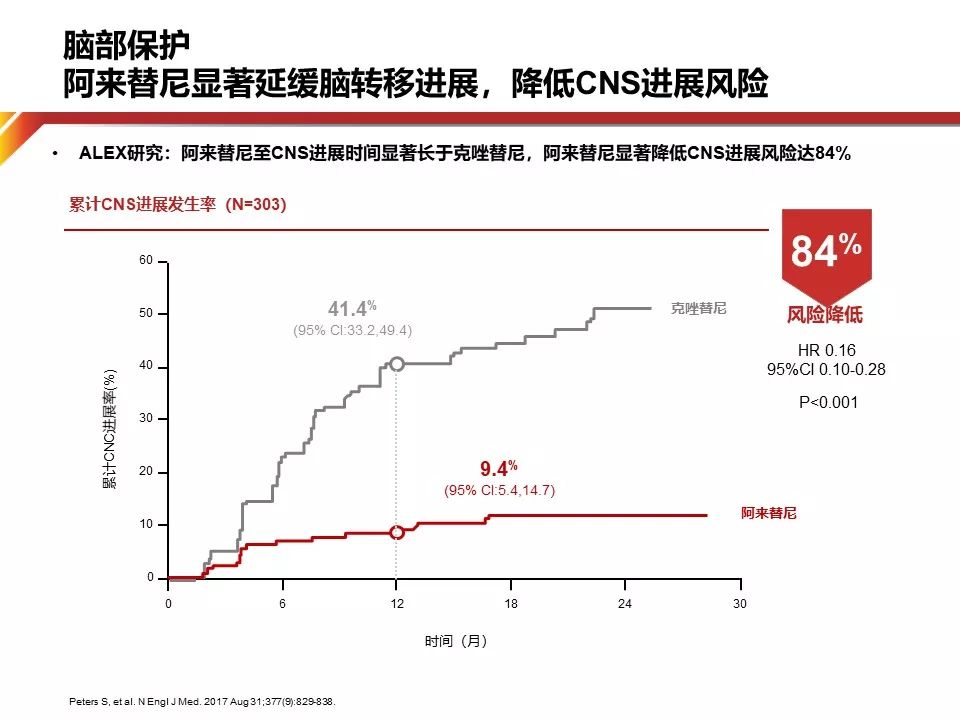
Alectinib用于一线获得如此久的PFS,除了肿瘤缓解以外,另外一个原因是脑保护作用,50%的ALK阳性患者以脑转移作为首先进展的病灶,因此延缓脑转移的发生对生存有巨大的贡献。在Alex研究中,Alectinib脑转移的风险比对照组降低84%。从总生存的角度来看,目前有限的数据告诉我们,目前的OS随访仅有随访28个月,尽管数据尚不成熟,但十分值得我们期待。
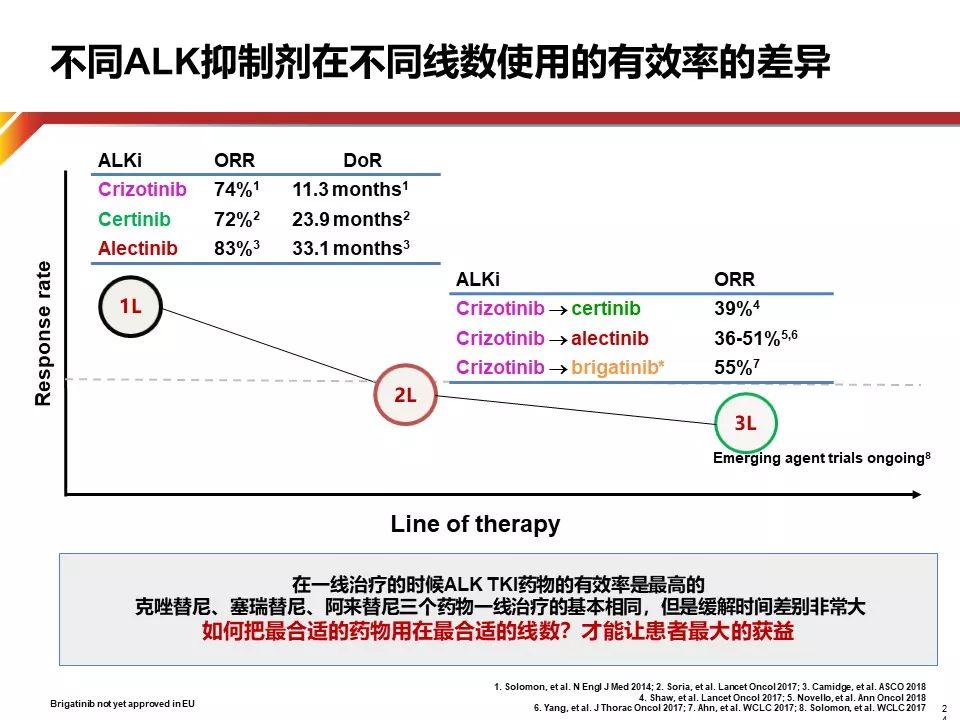
不同ALK抑制剂在不同线数治疗的PFS和ORR差异巨大,如何在最合适的线数放最合适的药物达到最好的疗效是全程管理的核心所在,这也对三代并存的TKI的排兵布阵有更高的要求。首先要考虑不同ALK抑制剂不同线数使用有效率的差异,如Alectinib一线使用ORR为83%,DOR达33.1个月,若要放到二线使用ORR则降低到36%-51%。因此,只有一线治疗的时候使用TKI的疗效才是最高的,TKI药物要先用。在指南中Crizotinib、Ceritinib、Alectinib均作为一线推荐,但PFS相差巨大,所以为患者选择一线最好的药物,才能让患者获益最大。
综上所述,我们如何看待ALK阳性NSCLC患者的治疗?通过优选的治疗策略,延长患者的生存时间。现今,Alectinib的上市开创了ALK阳性NSCLC的慢病管理时代,ALK阳性的患者可能是晚期非小细胞肺癌中最先走进慢性病的群体。
王洁教授:不一样的故事—34.8个月的秘密
Alectinib满足了我们对靶向治疗的所有期待,极大的帮助了我们将肺癌向慢性病推进。既往流行病学的数据告诉我们,ALK阳性的NSCLC与EGFR不同,更倾向年轻化,同时也更容易出现脑转移,预后更差。陪伴了我们多年的Crizotinib在ALK,ROS1,cmet三个靶点上均可取得11个月的PFS,可谓功不可没,但仍没有达到我们的期待。
那么产生如此好的疗效背后的原因究竟有哪些呢?可以从以下三点来阐述:
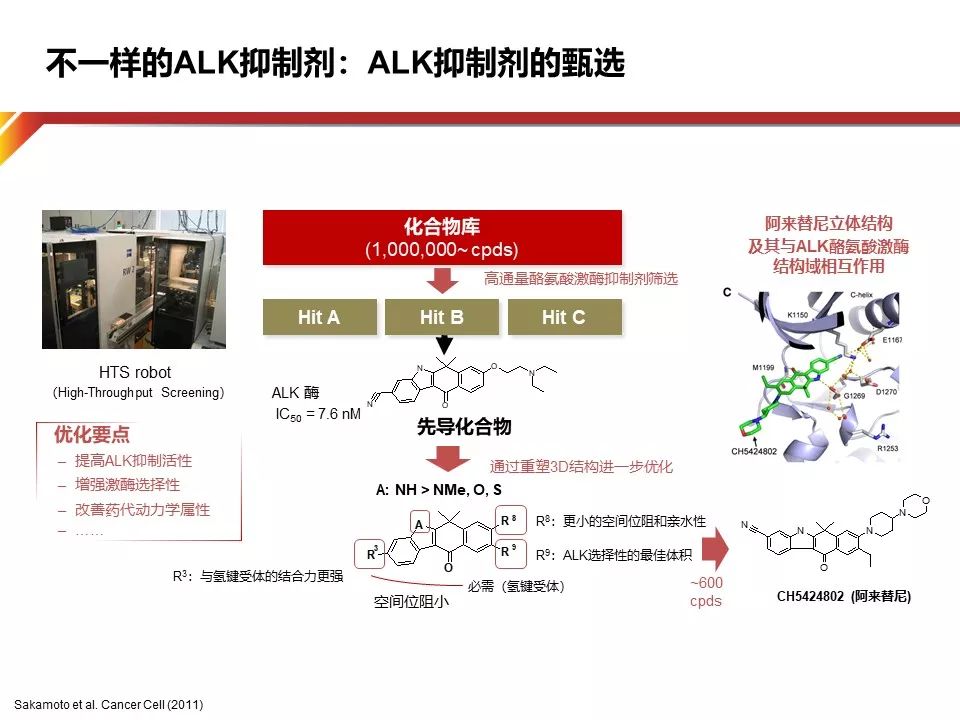
Alectinib独特的化学支架(一种苯并[b]咔唑衍生物),与ALK的激酶结构域以显著区别于Crizotinib的方式结合,能够克服由Crizotinib引起的激酶域的二次突变,对EML4-ALK以及ALK L1196M,G1269A,C1156Y,F1174L,1151Tins和L1152R具有显着的抑制效力。在临床研究中,对于激酶域二次突变的前摄性抑制(Upfront suppression of multiple mechanisms of resistance)能够有效推迟耐药的出现,在一线获得更长的疾病有效控制。值得注意的是,由于ALK高度选择,Alectinib对Ros1,MET不具有相同的抑制作用。
2、缓解深度更深
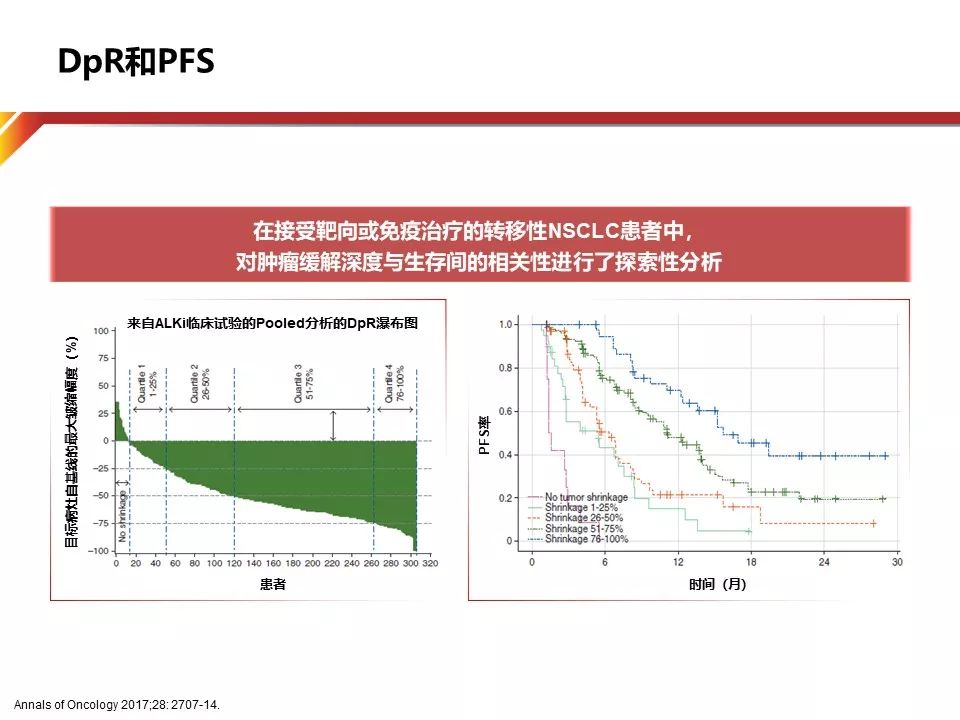
在实体瘤中,DpR(depth of Response)的定义是:靶病灶从基线开始到最大肿瘤缩小的比例。应用DpR进行评价的优点在于:相比于ORR(只能区分有肿瘤应答和无肿瘤应答),是一个对病例个体更有测量意义的指标,并且能够在以时间为终点的事件到达前(PFS,OS)反映肿瘤的应答情况。
在实体瘤中,肿瘤影响学的应答与生存终点(PFS/OS)的关系仍存在争议,尽管随着精准医学的发展和TKI类药物的研发增速,越来越多的临床研究采用ORR为替代终点 ,但肿瘤应答情况与疗效持续时间的关系仍未被清楚的回答。2017年一项研究根据病灶缩小的程度DpR分为5组(无缩小,缩小1-25%,缩小26-50%,缩小51-75%,缩小76-100%),结果显示,接受ALKi治疗并且达到较好的DpR的患者(50%)具有更好的长期生存趋势(Adjusted OS HR 0.28,PFS HR 0.05)
回归到ALEX研究,Alectinib对ALK激酶域有更强的亲和力。因此,Alectinib能更有效的抑制肿瘤生长,DpR更显著,最终取得更长的PFS。
3、预防脑转移
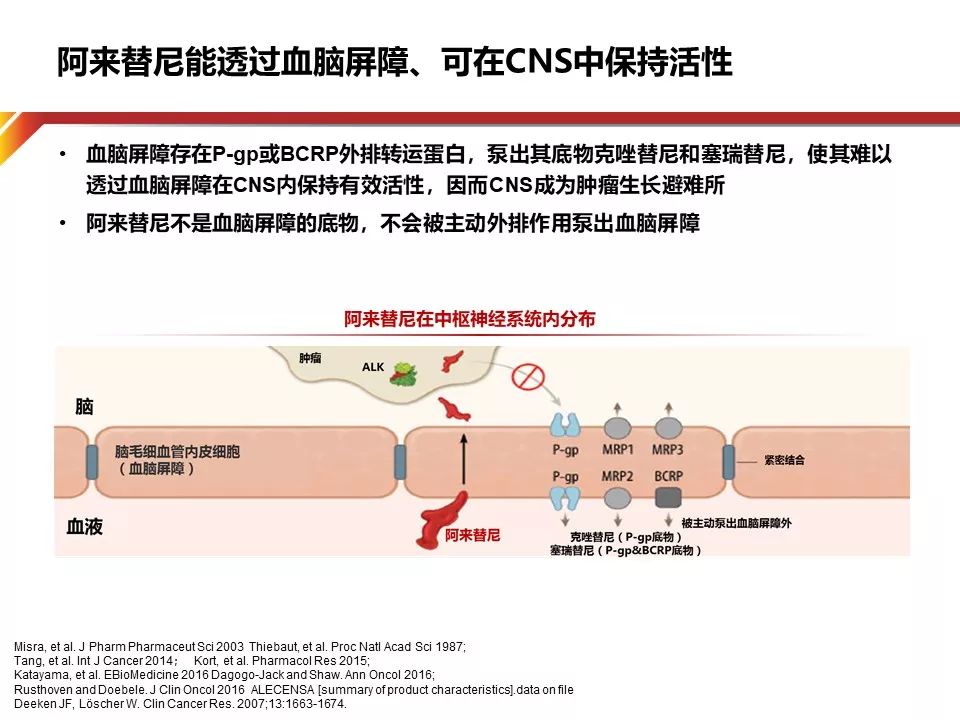
ALEX研究结果显示Crizotinib组和Alectinib组12个月的CNS进展累积发生率分别为41.4%和9.4%。Alectinib能有效预防脑转移的可能机制是——相比于其他药物,Alectinib能有效渗透进入中枢神经系统。其他的ALK抑制剂如Crizotinib和Ceritinib可以通过穿越血脑屏障的方式进入脑内,但血脑屏障包含P-gp和BCRP等药物外排转运蛋白,它们可在药物穿越血脑屏障进入CNS前,通过主动外排作用将其驱逐出血脑屏障。Crizotinib是P-gp的作用底物,而Ceritinib是P-gp和BCRP的共同底物,因此,Crizotinib和Ceritinib在CNS中可能无法达到控制疾病所需的暴露量,从而可使CNS成为肿瘤生长的避难所。与Crizotinib和Ceritinib不同,Alectinib不是P-gp的底物,因此其脑-血浆比率高。临床前研究显示,Alectinib可有效渗透进入CNS。因此,Alectinib在CNS中具有保护作用,可预防CNS转移的发生。
周彩存教授总结
在ALK阳性的肺癌中我们已经取得了不俗的成绩,聚焦于这5%的患者人群,产出了多篇NEJM的研究报道。还有更多的研究尚在进行之中。目前来看,Alectinib应当是ALK阳性NSCLC患者的一线首选方案,超越了其他的各种药物组合方式,这是十分令人鼓舞的。多名不同领域的专家进行了精彩的思维碰撞,从各个角度达成共识:更有效的药物,尽早的应用于治疗之中,可以给患者带来有效的生存获益。
41本肿瘤患者指南丛书
点击下方图片即可免费阅读
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情