大家好!本周为大家推荐一篇发表在Chem. Sci.上的文章:Epitope Alteration by Small Molecules and Applications in Drug Discovery,文章的通讯作者是来自哈佛医学院的冉崇昭和张灿,以及来自四川大学华西药学院的程妍。
抗原-抗体相互作用在基础研究、疾病诊断和治疗中有着广泛的应用,这主要得益于其高特异性、高亲和力与不易受环境干扰的特点。虽然盐和pH的变化基本上不会影响抗体对抗原表位的识别,但特定的小分子却可能造成影响。作者此前在研究靶向Aβ蛋白的药物时意外发现了几种可以抑制或增强抗体识别Aβ表位的配体,于是决定针对这一现象展开更深入的研究。
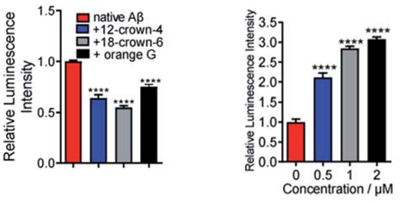
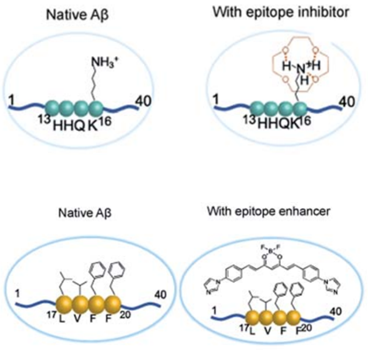
因为作者是在研究Aβ蛋白中发现这一现象的,所以首先以Aβ蛋白为模型研究了小分子对表位识别的调控作用。表位上的氢键和静电作用在抗体识别中发挥重要作用,Aβ的一个带电氨基酸K16就与抗体识别密切相关。作者将K16乙酰化或突变以中和掉电荷后,观察到抗体结合力显著降低。用冠醚和Orange G等小分子处理Aβ后,作者通过电位分析证明其表面电位大幅改变,而与之对应的是抗体的结合力也如预期般地降低了。为了证明这种现象的普遍性,作者又在PD-L1上测试了两种抑制剂对抗体识别的影响,结果表明其中一种抑制剂WL12也具有显著干扰抗体识别的作用。
接下来,作者展示了小分子增强而非抑制表位识别的例子。4G8抗体依靠疏水作用识别Aβ的17-24片段,将序列中疏水的F19和F20突变后结合力显著降低。作者此前发现了一种Aβ交联的抑制剂CRANAD-17可以与Aβ的16-20片段发生相互作用,在加入了CRANAD-17后,作者发现抗体的结合力增强了。通过ANS荧光分析,作者发现CRANAD-17的存在会使Aβ的17-24片段疏水性降低,证明了小分子可以通过调节疏水相互作用影响表位识别。FRET实验进一步表明,抗体识别的增强是由于CRANAD、Aβs和4G8三元复合物的形成。
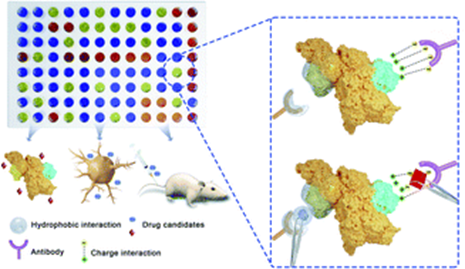
根据以上的研究,作者假设小分子对于表位识别的调控作用可以用于药物发现,因此提出了基于表位调控的药物筛选平台(SPEED)。作为概念性的验证,作者以Aβ1-40为靶标,筛选了一个包含1047种小分子的化合物库。以4G8抗体作为信号读取工具,筛选可以增强4G8结合的小分子。作者最终筛选出了2种化合物,GNF-5837和obatoclax,并在分子水平上验证了它们与Aβ的结合。作者还为这两种化合物找到了不同的应用,GNF-5837可以抑制Aβ的聚集,而obatoclax可以作为对Aβ进行体内成像的探针。 综上,作者研究了小分子调控抗体的表位识别的现象,并以此为基础建立了药物筛选平台SPEED。作者指出,SPEED的优势在于不需要对靶标蛋白或配体进行修饰或衍生,并且与多种免疫分析技术兼容,而需要抗原的表位结合信息的先验知识是其主要局限性。
本文作者:TZY 责任编辑:Guo ZH
文章链接: https://pubs.rsc.org/en/content/articlelanding/2022/sc/d2sc02819k 文章引用:DOI:10.1039/D2SC02819K