《Science》、《Nature》重磅来袭!张锋升级CRISPR新系统“REPAIR”!新型碱基编辑器精准转换碱基对
点击上方“公众号”可以订阅哦!
美国时间10月25日,Nature和Scinece同时报道两项重大的突破性研究。知名华人学者张锋教授的团队在Scinece上在线发表了一篇重磅论文——带来一款全新CRISPR系统“REPAIR”,能有效地对RNA中的腺嘌呤(A)进行单碱基编辑。有望在不修改基因组的前提下,精准地矫正致病的遗传突变。由麻省理工学院广泛研究所和马萨诸塞州剑桥的哈佛分校David Liu教授实验室主导开发的新基因编辑系统——腺嘌呤碱基编辑器(ABE),能将A-T碱基对转换为G-C碱基对。
张锋团队新突破,CRISPR新系统“REPAIR”
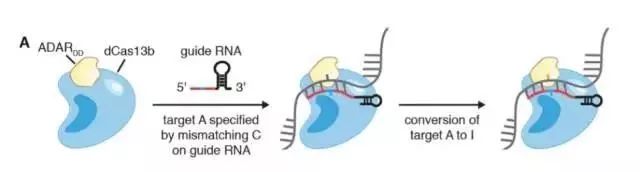
张锋团队的文章介绍了CRISPR新系统“REPAIR”。“REPAIR”的基本元件是一种取名为PspCas13b的酶和ADAR2蛋白。“REPAIR”可高效地修复RNA的单个核苷,因不会改变DNA信息而更为安全,将为基础研究和临床治疗提供一个新的工具。
张锋教授
在人类的疾病中,由鸟嘌呤(G)向腺嘌呤(A)的突变极为常见。类似的突变能在罹患局灶性癫痫(focal epilepsy)、杜氏肌营养不良、或是帕金森病的患者体内找到。因此,如果能逆转这一常见突变,把A矫正回G,就有望从根源上治疗这些疾病。
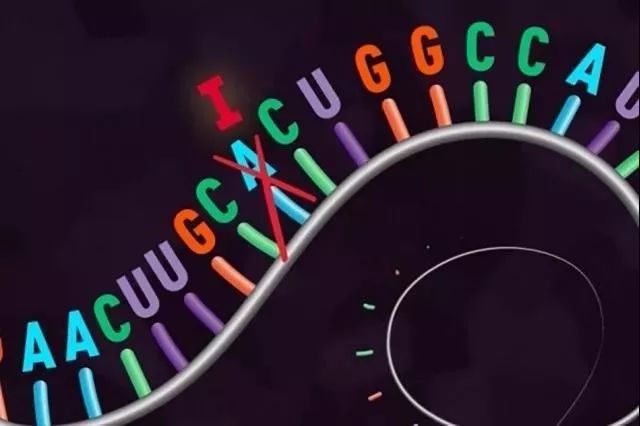
有趣的是,一步简单的反应就有望完成这个矫正的过程——腺嘌呤在脱氨后,会变成一种叫做肌苷的分子,而它与鸟嘌呤的结构非常接近,细胞甚至无法对这两者进行区分。换句话说,只要能让关键的腺嘌呤脱氨,就能完成从A到G的矫正,从而为患者带来治疗的希望。
一步简单反应,就能将腺嘌呤转为与鸟嘌呤类似的肌苷(图片来源:《科学》)
为了达成这个目标,张锋教授团队在CRISPR-Cas13的家族中开始寻找潜在的工具。与常见的Cas9不同,Cas13蛋白只靶向RNA,不会影响到基因组的遗传信息,从而进一步增加了基因编辑的安全性。在一番搜寻后,他们发现来自普雷沃菌(Prevotella bacteria)的Cas13b蛋白靶向RNA的活性最佳。随后,研究人员做了几个小改动,让Cas13b蛋白失去了“剪切”的能力,并把它和一种叫做ADAR2的酶融合到了一款。在人体中,ADAR2能够把RNA上的腺嘌呤转变为肌苷。
这套系统能把RNA上的腺嘌呤(A)转变为肌苷(I)(图片来源:MIT官方网站)
“这套系统不必惊扰基因组,就能修复突变。因为RNA会降解,这是一种可逆的修复。”该研究的共同第一作者、研究生David Cox说道。
按照研究人员的设想,CRISPR-Cas13b系统能把ADAR2送到RNA上的某个特异位点,把腺嘌呤转化为肌苷。在细胞看来,肌苷与鸟嘌呤别无二致,因此就能按鸟嘌呤处理,合成具有正常生理功能的蛋白质。这套系统被命名为“可编程的腺嘌呤到肌苷RNA编辑”(RNA Editing for Programmable A to I Replacement),缩写为REPAIR。
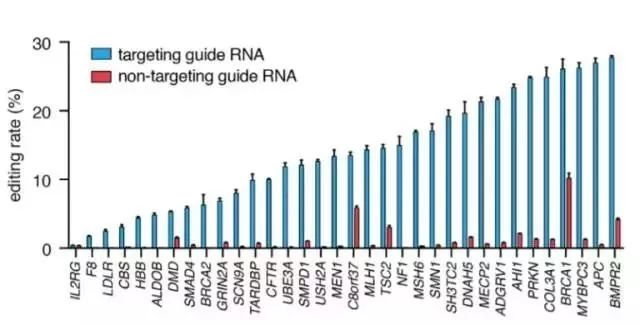
这套系统能有效矫正34种不同的疾病相关变异(图片来源:《科学》)
为了检验这一系统的治疗潜力,该团队在人类细胞中引入了能导致范可尼贫血症(Fanconi anemia)和X连锁肾源性尿崩症(X-linked nephrogenic diabetes insipidus)的致病突变,并检测其能否对其进行有效的修复。结果表明,在RNA的水平上,这些突变可以被有效矫正,这也从概念上支持了这套系统的可行性。
在开发出REPAIR后,张锋教授的团队进一步提高了它的特异性。在一系列的修饰后,这套系统的特异性大大提高,把全转录组中的可检测脱靶编辑数从18385锐减到20!在测试中,这款被称为REPAIRv2的系统编辑RNA的效率最高可达51%。
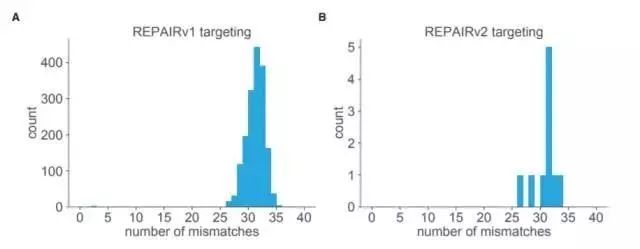
对此,该论文的另一名共同第一作者、博士生Omar Abudayyeh对这个结果感到振奋。他说,“这清楚地表明REPAIRv2能进一步演化。在保留特异性的同时,活性得到进一步提高。”
站在这一良好的起点上,研究人员们计划开发与之配套的递送系统,并在动物组织中继续验证REPAIRv2在体内的RNA编辑活性。此外,他们也将寻找全新的工具,用于其他类型的核苷酸转化。“我们一直期待驾驭自然的力量,用于这些转化。”该研究的另一名共同第一作者、博士生Jonathan Gootenberg评论说。
“矫正致病突变是基因组编辑的主要目标之一,”张锋教授评论道“目前为止,我们在让基因失活方面做得很成功,但要让已经失去的蛋白功能得到恢复,是更具挑战的一件事。编辑RNA的新能力带来了更多机遇,让我们能够恢复蛋白质的功能,治疗许多疾病。这几乎能用于所有的细胞。论文发表后,张锋教授宣布,该工具将免费向学术界发放。
新型碱基编辑器,DNA无断裂可进行碱基互换
同一天,Nature发表了来自美国博德研究所核心成员David Liu及同事的文章,报告了他们开发出的腺嘌呤碱基编辑器(ABE),能将A-T碱基对转换为G-C碱基对。

腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)和胸腺嘧啶(T)是构成DNA的基本单元。这些碱基按照A-T,C-G这样配对形式,搭建起DNA的双螺旋结构。而在RNA中,胸腺嘧啶(T)由尿嘧啶(U)替代。
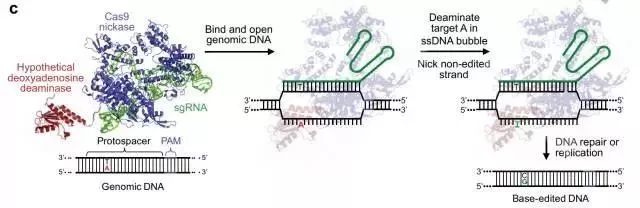
去年,同样发表在Nature杂志,David Liu及同事首次报告了他们的“碱基编辑器”,通过在Cas9蛋白上安装大鼠胞苷脱氨酶APOBEC1,Cas9的“剪刀”功能会消失,不再切割DNA双链,但仍能结合目标DNA片段,同时能将胞嘧啶(C)转化为尿嘧啶(U)。之后,再通过第三种蛋白,让细胞启动DNA修复程序,最终使得C-G碱基对替换为T-A碱基对。
碱基编辑器的作用机理(图片来源:《自然》)
David Liu及同事没有止步于去年的成果。科学家已经知道,在所有已知的疾病相关单碱基对突变中,约有一半和野生型G-C碱基对被转换成突变型A-T碱基对有关。而此次David Liu及同事报告的腺嘌呤碱基编辑器就可完成将A-T碱基对转换回G-C碱基对的任务,补上了去年成果中的遗憾。
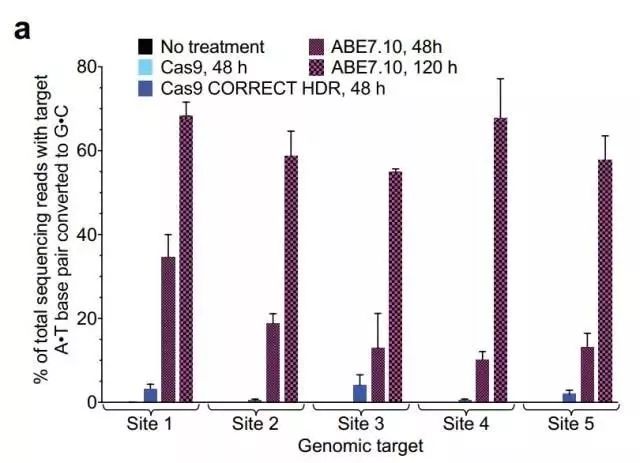
据报告,这一腺嘌呤碱基编辑器在细菌细胞和人体细胞中均能工作。在人体细胞中,它的效率为50%,且脱靶率很低,几乎不会造成随机插入、删除或其它突变的副作用。
参考资料:
[1] RNA editing with CRISPR-Cas13
[2] Researchers engineer CRISPR to edit single RNA letters in human cells
[3] New Version of CRISPR, Developed by Feng Zhang-Led Team, Can Target and Edit RNA
[4] Programmable base editing of A•T to G•C in genomic DNA without DNA cleavage
论文地址:
Scinece: http://science.sciencemag.org/content/early/2017/10/24/science.aaq0180
Nature: http://www.nature.com/nature/journal/vaap/ncurrent/full/nature24644.html
来源:药明康德、澎湃新闻
注:投稿请电邮至124239956@qq.com ,合作 或 加入未来产业促进会请加:www13923462501 微信号或者扫描下面二维码:
文章版权归原作者所有。如涉及作品版权问题,请与我们联系,我们将删除内容或协商版权问题!联系QQ:124239956