南京大学医学院:间充质干细胞衍生的外泌体通过传递miR-182改变巨噬细胞极化状态并减缓心肌缺血再灌注损伤
间充质干细胞(MSCs)参与了心脏炎症调节,但其中的机制非常复杂。心肌梗死后MSCs移植能有效抑制心肌损伤,MSCs分泌的外泌体可能发挥了重要作用。近日,来自南京大学医学院附属鼓楼医院徐标、谢峻课题组的研究人员发现,MSC衍生的外泌体(MSC-Exo)通过传递miR-182抑制TLR4活性,实现对心肌再灌注损伤后巨噬细胞的免疫调节作用。这项研究发表于Cardiovascular Research杂志上(IF 6.290)。
急性心肌梗死(MI)是心脏疾病中死亡和致残的主要原因,再灌注治疗可以减少急性心肌缺血性损伤和降低梗塞面积。然而,再灌注过程可能会诱发进一步的心肌损伤,这又被称为心肌再灌注损伤。缺血/再灌注(I / R)过程会触发心脏炎症级联反应,这种炎症反应的强度和持续时间与心肌损伤和瘢痕形成密切相关。在这个过程中,巨噬细胞在心脏炎症的调节中起重要作用。缺血再灌注后,M1型巨噬细胞会产生促炎环境,清除损伤的心肌细胞碎片。然后,M2型巨噬细胞会逐渐增多,M2型巨噬细胞不仅分泌抗炎细胞因子,还分泌一些生长因子的混合物,并在伤口愈合和瘢痕形成中起关键作用。因此,巨噬细胞两种独特的表型对于心肌梗死和愈合很重要。M1和M2型巨噬细胞之间的平衡发生变化,会影响M2巨噬细胞浸润,揭示其中的具体机制可能有助于治疗心肌I / R损伤。
间充质干细胞(MSCs)是一种独特的基质细胞类型,对缺血性心脏病的功能和结构修复有积极作用,包括减少梗塞面积、改善心脏功能、增强血管生成和调节炎症反应。一些研究已经证实MSCs可以减少巨噬细胞产生的促炎细胞因子,并在体内和体外引发巨噬细胞向抗炎的M2表型极化。然而,潜在的机制仍然是不完全清楚的。越来越多的证据表明,MSC通过其旁分泌作用对心肌细胞其作用,而不是分化直接为肌细胞参与。外泌体被认为是含有特定有效小RNA和蛋白质的囊泡,是MSCs分泌物中的有效成分,在MSC与其他细胞类型交流中起重要作用。研究表明,MSC衍生的外泌体(MSC-Exo)可以改善组织损伤和炎症性疾病动物模型的功能恢复。然而,心肌I / R损伤后的抗炎环境下,MSC-Exo是否可以诱导巨噬细胞产生还不清楚。
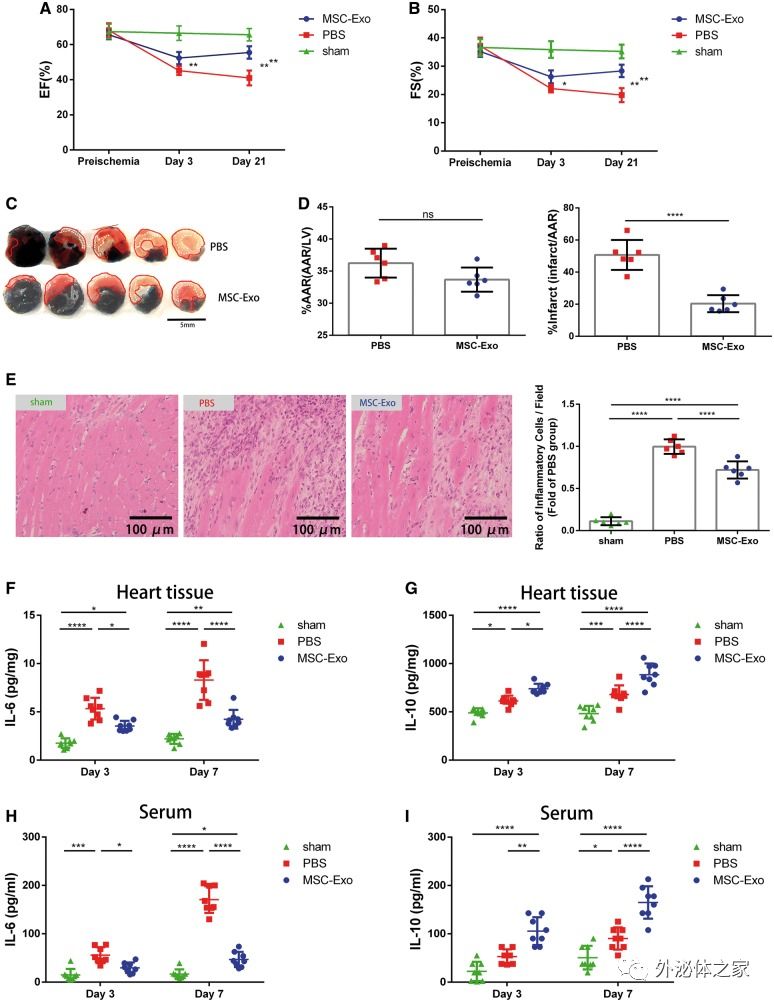
在这项研究里,研究人员探讨了MSC衍生的外泌体在心肌缺血/再灌注后巨噬细胞的免疫调节中的作用及其在心脏损伤修复中的意义。研究人员使用梯度离心法从MSC的上清液中分离了外泌体。在I / R后,通过心肌内注射给小鼠施用MSC-Exo减少了梗塞面积并减轻了心脏和血清中的炎症水平。用氯磷酸盐脂质体去除巨噬细胞,可以消除MSC-Exo的疗效。 MSC-Exo在体内和体外均可以促使M1巨噬细胞的极化至M2巨噬细胞。MSC-Exo的miRNA测序和生物信息学分析结果显示,miR-182是巨噬细胞极化的靶标,而且toll样受体4(TLR4)是其下游基因。降低MSC-Exo中的miR-182水平可以部分减弱其对巨噬细胞极化的调节。TLR4的敲低也赋予心肌I / R小鼠模型中的心脏保护功效并降低炎症水平。这些数据表明,MSC-Exo通过在心肌细胞微环境间的穿梭,改变了巨噬细胞极化状态,并通过外泌体中的miR-182减轻小鼠心肌I / R损伤。该研究为MSC-Exo作为心肌I / R损伤的潜在治疗工具的应用提供了新的见解。
图:MSC-Exo的小鼠心肌内输注减轻了心肌I / R损伤和心脏炎症
参考文献:Zhao J, Li X, Hu J, Chen F, Qiao S, Sun X, Gao L, Xie J, Xu B. Mesenchymal stromal cell-derived exosomes attenuate myocardial ischaemia-reper fusion injury through miR-182-regulated macrophage polarization. Cardiovasc Res. 2019 Jun 1;115(7):1205-1216.
【科研成长加油站】
2019年中国肿瘤标志物学术大会暨第十三届肿瘤标志物青年科学家论坛
系统评价与meta分析学习班和临床科研设计和数据管理学习班( Meta班:6/27-30日;上海临床管理班:7/2日-4日)
回复“外泌体” 阅读外泌体最新科研进展及动态
回复“EV” 阅读 2016-2018年This Week in Extracellular Vesicles
回复“盘点” 阅读 外泌体领域十大前沿进展盘点