【WCLC 2017】阿帕替尼再发声,两项研究三度登陆国际大会
青岛大学附属医院肿瘤医院院长张晓春教授
当地时间2017年10月15日-18日,第十八届世界肺癌大会(WCLC)正在日本横滨举行。来自世界100多个国家的7000余名肺癌及其他胸部肿瘤专家参与了这一盛会。
阿帕替尼作为我国自主研发、针对VEGFR-2的小分子抗血管生成酪氨酸激酶抑制剂。自2014年10月批准上市以来,阿帕替尼在晚期胃癌中的疗效和安全性已得到临床验证;同时,在其他多个瘤种的临床探索也取得了初步成果。在今年的WCLC上,有8项阿帕替尼在肺癌领域的研究成果进行了公布,其中有两项研究,更是先后在今年的ASCO、WCLC和即将在悉尼召开的澳大利亚临床肿瘤学会年会(COSA)上进行了发布和更新。
这两项非干预、单臂、登记性研究由青岛大学附属医院肿瘤医院院长张晓春教授团队领衔,回顾性收集和整理了2015年-2017年来院就诊的原发性肺癌患者和其他实体瘤伴肺转移患者参与阿帕替尼治疗的情况,并进行了相关疗效及安全性的考察和分析。
登陆本次WCLC的两篇摘要,分别评估了肺部空洞形成和CEA对于原发性肺癌患者和其他实体瘤伴肺转移患者PFS的影响。
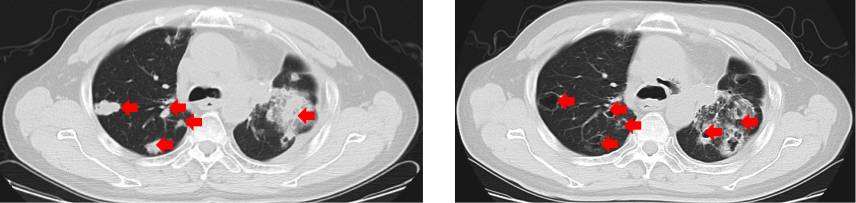
(患者服用阿帕替尼后肺部病灶形成空洞)
38例三线及三线后口服阿帕替尼的原发性肺癌患者中,37例口服剂量为250mg,1例患者服用500mg作为起始剂量。治疗期间,有20例患者(占比52.6%)形成了肺部空洞。空洞的形成在年龄、性别、肺癌分型、分期、手术史及阿帕替尼特征反应等分层因素上均未显示显著差异。空洞形成伴随短期CEA升高,形成空洞病灶和未形成空洞病灶的患者中,发生CEA升高的百分比分别是65.0% 和 5.6%。形成空洞病灶的患者中位PFS为11.25个月(95% CI, 10.16-13.64),相较未形成空洞病灶的患者中位PFS(6.11个月,[95% CI, 6.01-6.71];P<0.0001)有明显的提高。此外,发生短期CEA升高的患者中位PFS相较未发生短期CEA升高的患者中位PFS也有提高,但未做出明显统计学差异(10.64个月 [95% CI, 10.09-14.14] vs. 6.14个月 [95% CI, 6.07-8.13];P=0.0703)。
64例口服阿帕替尼的实体瘤伴随肺转移癌患者中,23例胃癌患者(占比35.9%)、14例结直肠癌患者(占比21.9%)、10例肝癌患者(占比15.6%)。有98.3%的患者口服剂量为250mg,其余患者服用500mg作为起始剂量。治疗期间,也有20例患者(占比31.3%)形成了肺部空洞。由于这些患者在治疗前的影像检查中,均未见空洞病灶,因此认为肺部空洞的形成是患者服用阿帕替尼导致的。空洞的形成在年龄、性别、肺癌分型、分期、手术史及阿帕替尼特征反应等分层因素上均未显示显著差异。形成空洞病灶和未形成空洞病灶的患者中,发生短期CEA升高的百分比分别是85.0% 和 34.1%。形成空洞病灶的患者中位PFS为15.44个月(95% CI, 12.12-20.65),相较未形成空洞病灶的患者中位PFS(6.71个月,[95% CI, 6.11-8.13];P<0.0001)有明显的提高。此外,发生短期CEA升高的患者中位PFS相较未发生短期CEA升高的患者中位PFS也有提高,但未显示明显统计学差异(11.15个月 [95% CI, 6.71-15.44] vs. 8.13个月 [95% CI, 6.31-15.57];P=0.3047)。
这两项研究的结果显示阿帕替尼无论是在原发性肺癌还是在实体瘤伴肺转移的患者中,都可能具有诱导肺部空洞产生的趋势,肺部空洞的产生可能伴随CEA的短暂升高,而肺部空洞化有可能对改善患者PFS起到相当积极的影响,对其机制的进一步研究有可能协助发掘潜在的生物标志物,从而对患者的生存及预后发挥积极作用。
张教授团队在这两项研究登陆WCLC之前,系列研究结果在今年的ASCO上进行了首次公布。而进一步的研究成果将在即将在悉尼举办的澳大利亚临床肿瘤学会年会(COSA)上进行发布。
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情