清华生命学院江鹏课题组发文报道肿瘤细胞调控瓦博格效应的新机制
11月8日,清华大学生命学院江鹏课题组在《自然·通讯》(Nature Communications)期刊发表了题为《TAp73通过调控磷酸果糖激酶促进瓦博格效应和肿瘤细胞增殖》(TAp73-induced phosphofructokinase-1 transcription promotes the Warburg effect and enhances cell proliferation)的研究论文,为揭示TAp73蛋白在人类肿瘤中令人困惑的功能特征提供了实验证据,同时为临床治疗TAp73高表达肿瘤提供了潜在的药物靶点。
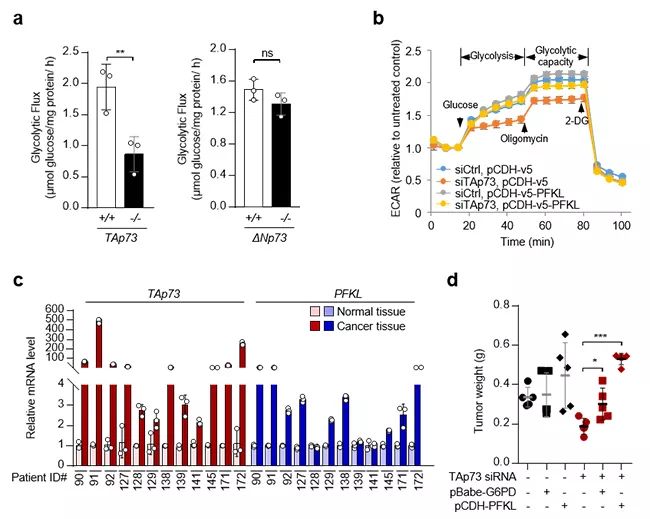
图a,利用碳13标记的葡萄糖代谢流分析TAp73野生型细胞和TAp73缺陷细胞,以及ΔNp73野生型与ΔNp73缺陷细胞的葡萄糖酵解活性。图b,Seahorse实验分析对照组细胞,TAp73敲低和磷酸果糖激酶PFKL过表达的肿瘤细胞的胞外酸化率(ECAR)。图c,TAp73和PFKL基因在不同结肠癌病人的表达分析。图d,小鼠成瘤实验表明PFKL的过表达可以回补TAp73缺失肿瘤细胞的成瘤能力。
瓦博格效应是肿瘤的重要代谢特征。但是,肿瘤细胞如何调控这一效应至今仍然不是很清楚。TAp73是肿瘤抑制因子p53家族蛋白。但与p53完全不同的是,TAp73在很多人类肿瘤中都存在高表达的现象,并且极少发生突变。这一现象暗示,TAp73并不像人们普遍认为的那样拥有肿瘤抑制的功能。相反,在人体内,其可能对肿瘤的发生、发展具有促进作用。
2013年,课题组的一项研究发现,TAp73通过调控磷酸戊糖途径的限速酶(Glucose 6-phoshpate dehydrogenase,葡萄糖-6-磷酸脱氢酶)的表达,增强肿瘤细胞的生物合成,抗氧化和增殖能力。但是,磷酸戊糖途径活性的恢复并不能完全回补TAp73缺失肿瘤细胞的增殖表型,因而,应当存在磷酸戊糖途径以外的其它代谢机制介导了TAp73的致癌功能。为了探索这个问题的答案,课题组近期系统地研究了TAp73在肿瘤代谢中的调控作用。本项研究工作发现,TAp73同时还参与了肿瘤细胞对糖酵解途径的调控。
深入的体内、体外分子机制研究、以及临床样本分析表明,TAp73可以通过转录的方式上调糖酵解过程中的第一个限速酶-磷酸果糖激酶(phosphofructokinase-1)的表达,进而促进肿瘤细胞糖酵解活性和乳酸的释放,促进了瓦博格效应。磷酸果糖激酶的激活导致了ATP的大量合成,增强了肿瘤的抗氧化能力。更为重要的是,磷酸果糖激酶的激活在小鼠体内可以恢复TAp73缺失肿瘤细胞的成瘤能力。这项研究揭示了TAp73是肿瘤细胞调控葡萄糖代谢的重要因子,为解释其在人类肿瘤中令人困惑的功能特征提供了实验证据,也为临床治疗TAp73高表达肿瘤提供了潜在的药物靶点。
清华大学生命学院2014级博士生李乐和2013级本科生李丽佳为该论文的共同第一作者。清华大学生命学院江鹏研究员为论文通讯作者,宾夕法尼亚大学杨小鲁(Xiaolu Yang)教授和北京协和医学院杜文静教授为论文的共同通讯作者。该研究由国家自然科学基金委、教育部、生命科学联合中心博士研究生项目(CLS项目)提供的经费支持。
论文链接:
http://www.nature.com/articles/s41467-018-07127-8

来源:清华新闻网
供稿:生命学院