▲点击上方的蓝色“医谷”关注我们
“置顶公众号”即刻获取最有价值行业趋势信息
医谷微信号:yigoonet
随着新版药品管理法的通过,业内普遍认为,传闻已久的GMP认证和GSP认证取消即将照进现实,然而,日前药监局的一则意见则增加了这个看法的不确定性。
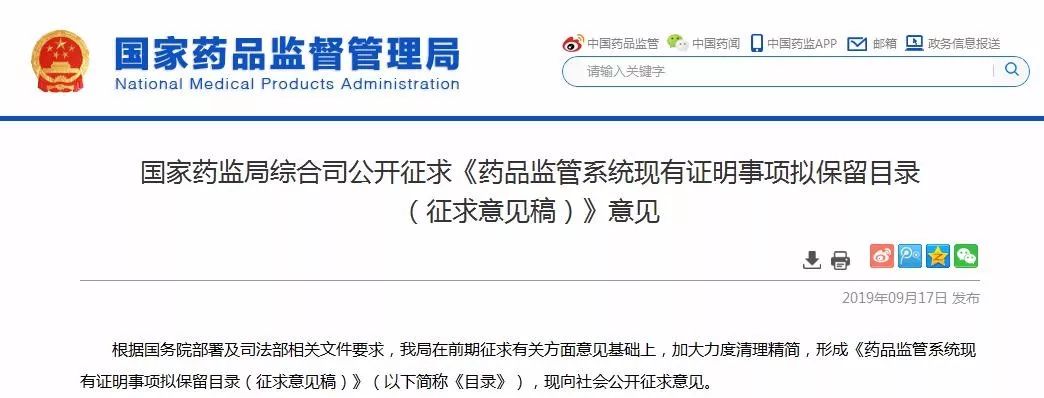
近日,国家药监局综合司就《药品监管系统现有证明事项拟保留目录(征求意见稿)》公开征求意见,列出了药品监管系统现有证明事项拟保留目录(征求意见稿)》(以下简称《目录》),其中GMP认证和GSP认证仍在拟保留项目中,根据目录,目录显示,拟保留营业执照、药品生产许可证、药品经营许可证、药品生产质量管理规范认证证书、药品经营质量管理规范证书、检验报告、药物临床试验批件或临床试验通知书等105项证明事项。
![]()
有分析人士表示,一旦上述征求意见稿通过,那就意味着GMP、GSP暂缓取消,这也意味着GMP、GSP认证将继续作为独立的行政行为,颁发相应证书。
对此,很多业内人士纳闷道:
在新近通过的新版药品管理法修订案中,其中删除了“药品监督管理部门按照规定对药品生产企业/经营企业是否符合《药品生产质量管理规范》/《药品经营质量管理规范》的要求进行认证;
对认证合格的,发给认证证书。
”且明确未来将与药品生产许可和经营许可一并检查,且相关部门可随时对GMP/GSP的执行情况进行检查。
但国家药监局在《意见》中表示,证明事项清理范围限定在由药品监管部门规章、规范性文件明确规定的,行政相对人在办理行政许可、行政确认和行政给付等过程中需要提供的证明事项。
照“四个最严”要求,将事关群众用药安全,在行政许可、行政确认和行政给付等过程中确有必要,且目前尚无法实现全面有效信息共享核查的证明事项,统一列入《目录》,很显然,GMP、GSP在行政管理中具有重要作用,而且取消的条件还不充分,继续保留GMP、GSP,有利于政府部门对行业的监管。
同时,《意见》也表示,将实行动态管理,随着法律体系的不断完善和信息化水平的不断提高,适时对证明事项进行调整。
鼓励地方先行先试进行探索,各省、自治区、直辖市药品监管部门可结合自身实际,在条件具备的前提下,逐步自行取消有关证明事项,这也给GMP、GSP认证的取消留了一条后路。
有业内人士提醒,即使最终有一天GMP、GSP确定完全取消,也绝不是意味着相关职能部门监管的放松,相反,会逐渐转型为动态的事中事后监管,对企业的监管力度反而更强。
1998年,中国参照国际标准推出GMP认证,对企业从厂房到地面、设备、卫生、空气和水的纯化等各项生产环节提出明确要求,并强调所有药品不通过认证不得生产,在当时,GMP/GSP强制认证制度曾在淘汰重复低效产能方面作出重要贡献,是规范国内药企小散乱的利器。
近年,国家更是建立了专业化的人才队伍加强药品监管。
2019年7月18日,国务院办公厅发布文件《关于建立职业化专业化药品检查员队伍的意见》,文件显示,职业化专业化药品(含医疗器械、化妆品)检查员是指经药品监管部门认定,依法对管理相对人从事药品研制、生产等场所、活动进行合规确认和风险研判的人员,是加强药品监管、保障药品安全的重要支撑力量。
国家建立药品检查员队伍的目的在于构建起基本满足药品监管要求的职业化专业化药品检查员队伍体系,进一步完善以专职检查员为主体、兼职检查员为补充的职业化专业化药品检查员队伍,形成权责明确、协作顺畅、覆盖全面的药品监督检查工作体系,该队伍的建立也在一定程度上体现了将会对药企日常检查和飞行检查增加力度和频率。
除了日常飞行检查,针对医药行业的专项检查亦非常频繁,如近期的财政部将对77家药企开展会计信息质量专项检查,更是引起了行业不小的波动。
而这些检查,无一不是多部门联合实施,并且建立了信息共享与违法线索移交机制,致使药企税务问题凸显。
总而言之,GMP、GSP认证不管是否最终取消,药企面临的更加严厉的监管态势已是不容置疑。
文 | 医谷
今日阅读排行榜 点击左下方“阅读原文”浏览
![]()
精准医疗产业班课程诚邀体验,更多详情请点击这里
![]()
医谷:拥有最全医学大健康产业信息来源渠道,紧跟政策风向,传播最新行业资讯;聚集国内外知名投资机构投资人,挖掘跟踪创新项目,实现项目资本快速对接;网罗大量会展信息及展后报道,聚焦热门产品技术,阐述专家大咖独到见解。
![]()
张江科学城南部核心区,城市副中心——上海国际医学园区期待您的考察莅临,共谋发展,021-68119996。