探索胶质瘤免疫治疗 301医院利用GBM外泌体构建DC疫苗
论文作者:刘鸿宇*,陈凌*,刘嘉霖*,孟恒星,张嵘,马林,吴亮亮,于松岩,时飞,李颖,张丽君,王玲兄,冯世宇,张琪,彭耀军,吴其艳,刘纯希,常鑫,杨霖,植村靖史,余新光(通讯作者),刘天懿(通讯作者)
该研究在国际上首次利用GBM来源外泌体和活化iNKT细胞佐剂联合致敏DC疫苗进行动物实验,在GBM大鼠原位肿瘤模型的治疗中表现出显著效果,属于探索性、前瞻性研究,为即将开展的多中心、大样本临床试验积累了证据。
GBM因复发率高,生存期短的临床特点,其标准治疗方案是手术后辅以同步放化疗继而标准化疗,但疗效改善并不显著。癌症免疫疗法是一个重要而有前景的发展方向,DC疫苗可以通过递呈肿瘤抗原刺激机体自身免疫系统,诱导患者主动免疫,增强特异性免疫应答从而杀伤肿瘤细胞。虽然免疫治疗在部分恶性实体肿瘤中初见成效,但GBM免疫治疗发展仍然面临艰难挑战。
目前,解放军总医院神经外科肿瘤免疫治疗相关研究已整体布局、全面铺开,神经外科与肿瘤中心组成的神经肿瘤免疫治疗研究团队在GBM免疫治疗方面已取得初步成果。
DC参与细胞介导的免疫反应,是目前已知体内最强的抗原递呈细胞,通过递呈肿瘤相关抗原(TAA)和共刺激信号,活化肿瘤特异性淋巴细胞,从而激发体内强效免疫应答反应,杀伤肿瘤细胞。
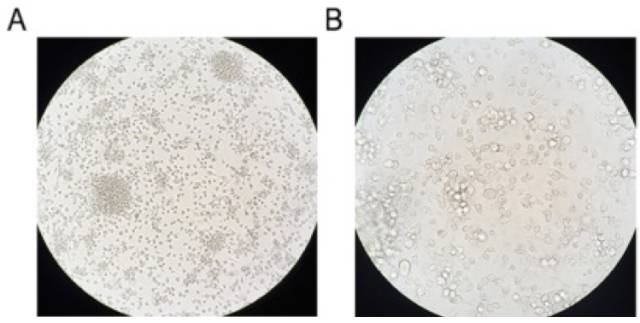
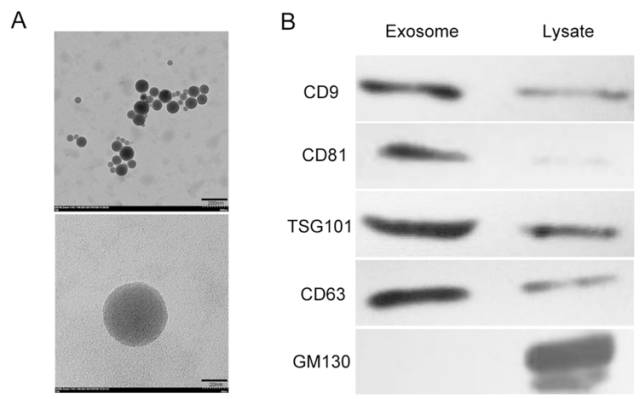
图2 大鼠C6细胞株来源外泌体鉴定。(A)透射电子显微镜下的形态。(B)外泌体与肿瘤细胞裂解物的免疫蛋白印迹分析。
国际上已报道的DC疫苗治疗GBM研究中,GBM患者生存获益并不稳定。该研究创新性采用外泌体(exosome)致敏DC,因其含有与来源细胞相关的蛋白质和核酸,也包括肿瘤相关抗原,较肿瘤细胞裂解物,能更有效致敏DC,增强抗肿瘤免疫应答。同时采用DC递呈的特定糖脂质抗原(α-GalCer)活化、扩增体内自然杀伤T(iNKT)细胞。iNKT细胞不仅具有直接抗肿瘤作用,而且作为细胞佐剂,通过与DC相互作用促进DC 抗原递呈功能,产生大量细胞因子,改善癌周微环境的免疫抑制。
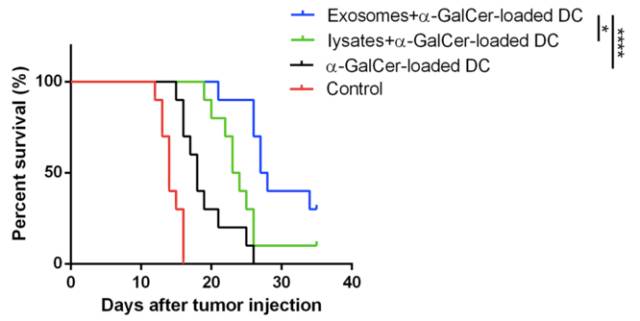
在GBM大鼠模型生存分析中,与对照组及肿瘤细胞裂解物组相比,外泌体联合糖脂质致敏DC治疗组中位生存期显著延长,肿瘤细胞接种27天后存活率达到了90%。
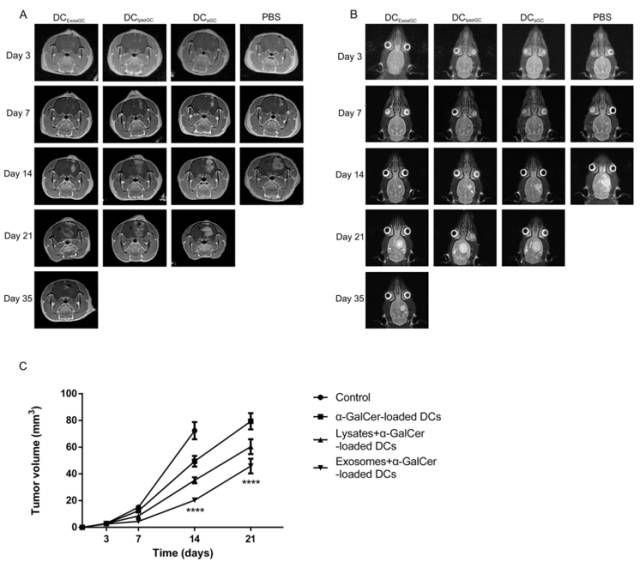
接种C6细胞后第3、7、14、21、35天的MRI扫描观察。外泌体联合糖脂质致敏DC治疗组肿瘤生长速度较其他组慢,且第21天时在轴位3DFSPGR增强图像上可以看到中心大部分肿瘤组织坏死。且有部分肿瘤模型第35天时轴位3DFSPGR增强图像上已看不到明显肿瘤生长。
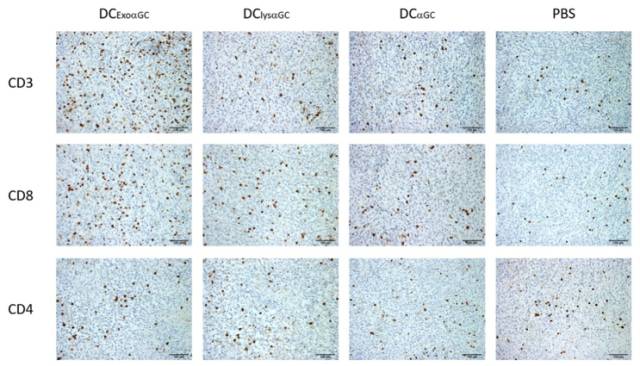
外泌体联合糖脂质致敏DC治疗组免疫组化分析,表现出更多CD8+和CD3+T淋巴细胞浸润。
外泌体联合糖脂质致敏DC治疗组血清中IFN-γ,IL-12p70,IL-4, IL-13, TNF-α水平明显升高,IL-10和IL-17A水平明显降低。提示肿瘤细胞来源外泌体联合糖脂质致敏DC疫苗可以通过调节免疫刺激因子和免疫抑制因子释放,有效改善GBM免疫微环境,解除免疫抑制。
结论:肿瘤细胞来源外泌体作为一种更有效的新抗原,与iNKT细胞佐剂协同作用,改善癌周微环境免疫抑制,诱导DC介导的强效抗原特异性抗肿瘤免疫应答。肿瘤来源外泌体联合糖脂质致敏DC疫苗为GBM免疫治疗提供新的策略。
科研学习班推荐 (点击详细了解):