微生物,大影响:iHMP最新研究进展
(图源:Lita Proctor, Nature, 2019)
撰文 | 计永胜
责编 | 陈晓雪
● ● ●
人体内生存着多种多样的微生物,包括真菌、细菌和病毒等,约占我们体重的1%到3%。它们通常对人体无害,有些甚至还能通过制造维生素、分解食物、调节免疫等途径保障我们的身体健康。这些微生物形成一个庞大的群体,被称为微生物组(Microbiome)。越来越多的研究表明,人体微生物组的变化与许多疾病的发生有关,改善微生物组可能应用于疾病的治疗。
鉴于此,最近十年,包括美国、欧盟、加拿大、中国、爱尔兰、韩国和日本在内的国家均开展了人类微生物组学研究,相关科研经费已达17亿美元 [1]。
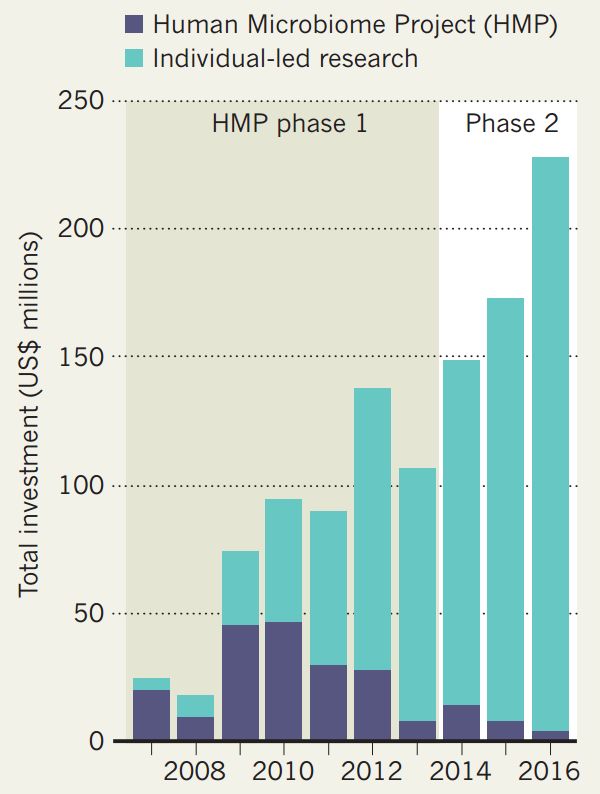
美国国立卫生研究院(NIH)于2007年启动了人类微生物组项目(Human Microbiome Project,HMP)(图1)。
图1. 2007-2016年美国HMP研究的经费投入。(图源:参考文献1)
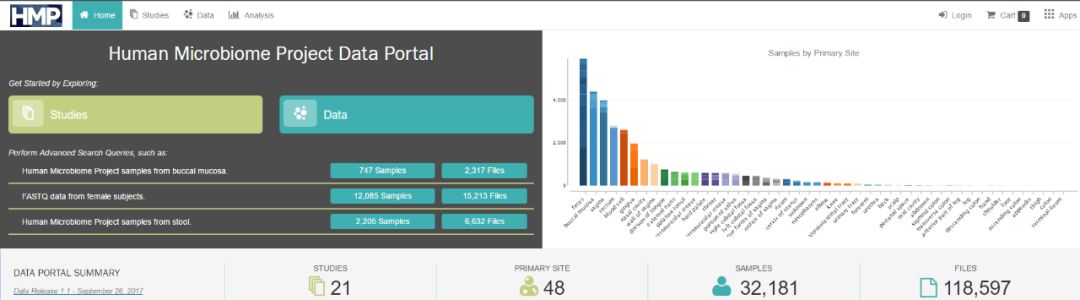
HMP分两期实施。一期研究已经于2013年结束,相关结果以数据库的形式向全球共享(图2,https://portal.hmpdacc.org/)。
图2. HMP(一期)数据入口。
(图源:https://portal.hmpdacc.org/)
HMP二期,即整合人类微生物组项目(The Integrative Human Microbiome Project,iHMP)于2014年启动,主要研究微生物组与疾病的关系,包括怀孕与早产(Multi-Omic Microbiome Study: Pregnancy Initiative, MOMS-PI)、炎症性肠病(The Inflammatory Bowel Disease Multi-omics Data, IBDMDB)和2型糖尿病(Type 2 diabetes mellitus, T2D)等3个项目,由弗吉尼亚联邦大学、哈佛大学、斯坦福大学和杰克逊实验室等多家科研机构执行(图3)。
图3. iHMP的三大研究方向。(图源:https://www.hmpdacc.org/ihmp/)
时隔五年,iHMP研究进展怎样了呢?
2019年5月30日,《自然》、《自然·医学》杂志集中在线刊发了iHMP的最新研究结果 [2-4]。
怀孕与早产项目(MOMS-PI)
早产是新生儿死亡的第二大原因,全球每年的早产儿数目大约是1500万。
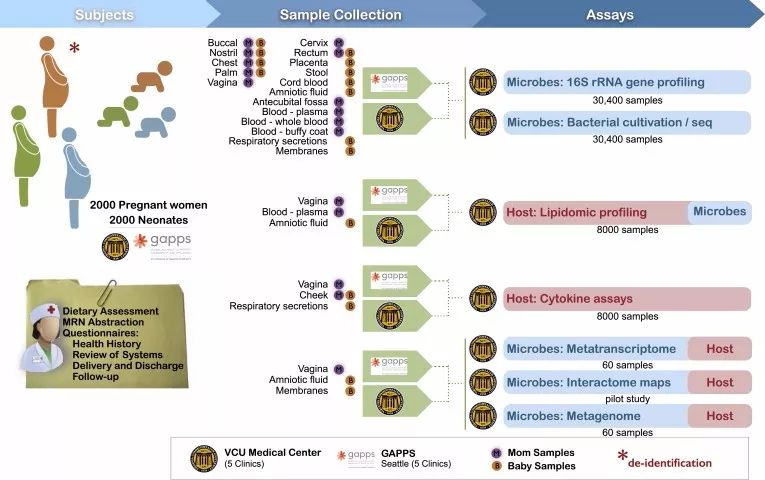
弗吉尼亚联邦大学教授 Gregory A. Buck 领衔的 MOMS-PI 研究团队纵向跟踪了1572名妇女的整个怀孕生产过程,共采集了包括产妇不同部位(生殖道、口腔、皮肤、直肠和鼻腔)、血液和尿液以及新生儿不同部位(脐带、口腔、皮肤和直肠)、脐带血和排泄物(胎粪和首次粪便)中的微生物样本206437份(图4)。这些样本均经过了基因分类学分析、基因组和转录组测序、细胞因子分析、脂类组学分析、细菌基因组分析等多组学分析。其中来自597名妇女的12039份样本用于后续分析微生物组动态变化以及与早产的关系。
图4. MOMS-PI参与团队及研究流程。(图源:参考文献5)
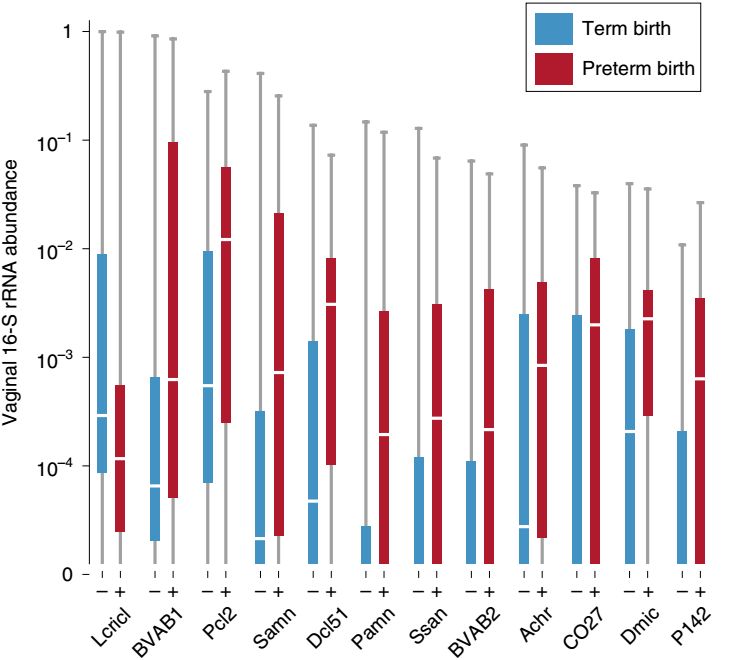
结果显示,早产(妊娠少于37周)孕妇(非洲裔妇女居多)的生殖道中的卷曲乳杆菌(Lactobacillus crispatus)水平低于足月(妊娠超39周)妊娠的孕妇,而属于普雷沃菌属(Prevotella spp)、戴阿李斯特属(Dialister spp)、毛螺菌科(Lachnospiraceae)、红蝽杆菌科(Coriobacteriaceae)、小单胞菌属(Parvimonas spp)等的11种微生物的水平要高于足月妊娠的孕妇(图5)。同时,在整个妊娠期间,早产孕妇的生殖道微生物菌群多样性逐渐降低。
图5. 早产孕妇和足月妊娠孕妇生殖道中微生物主要差异。(图源:参考文献2)
此项研究为在妊娠前期进行早产风险评估提供了参考数据。
炎症性肠病项目(IBDMDB)
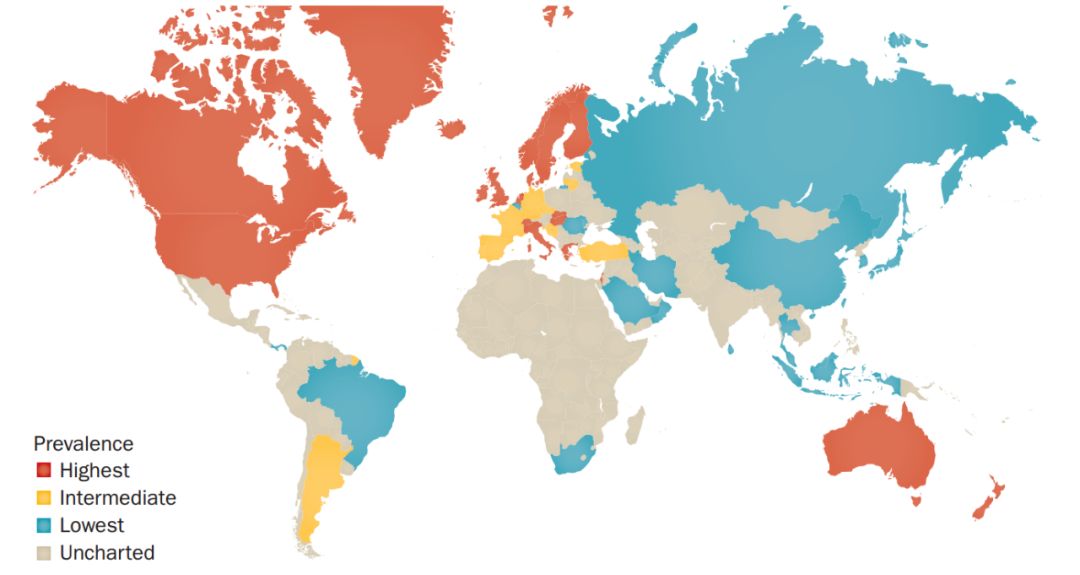
炎症性肠病(IBD)是在西方国家流行率较高的慢性肠道疾病,包括溃疡性结肠炎(Ulcerative Colitis)和克罗恩病(Crohn’s Disease),如不及时治疗可能诱发组织癌变(图6)。全球有超350万人受其困扰。
图6. 2015年IBD全球流行情况。(图源:Kaplan, G. G. Nat. Rev. Gastroenterol. Hepatol.)
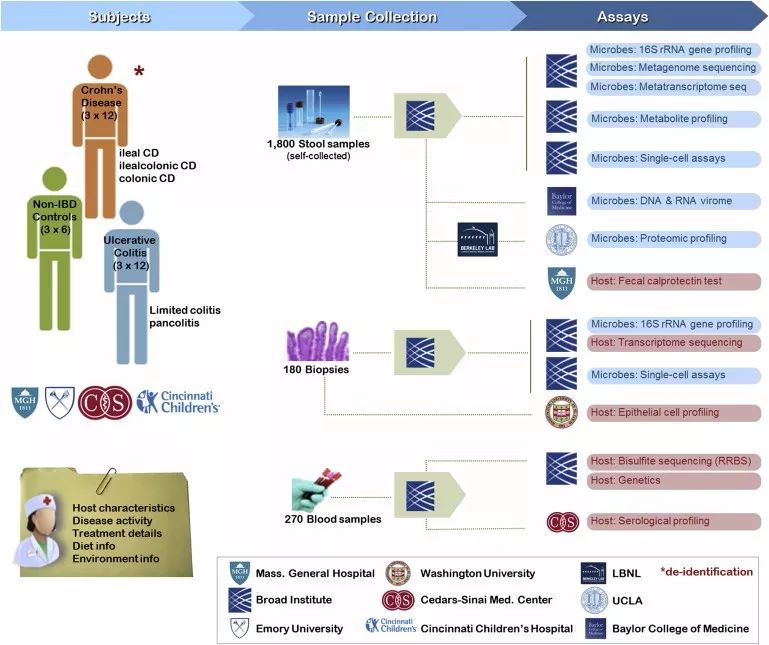
在IBDMDB项目中,来自哈佛大学、麻省理工学院等机构的科研人员用一年的时间从132名IBD患者采集了2965份样本,包括活组织、血液、粪便等。运用与MOMS-PI相似的多组学深度分析方法,该团队系统绘制了IBD患者体内的微生物组学图谱,并重点描述了微生物菌群功能失调的情况(图7)。
图7. IBDMDB参与团队及研究流程。(图源:参考文献5)
研究发现,IBD 患者体内的代谢产物和微生物种群的多样性均显著降低,并且微生物种类随发病时间变化得更加频繁,菌群不稳定性增加。例如,在IBD患者样本中,专性厌氧菌数目降低,而兼性厌氧菌的数目增多。相应地,人体的某些基因表达也在发生变化,比如抑制革兰氏阴性菌生长的 SAA2、合成活性氧分子的 DUOX2、干扰微生物离子代谢的 LCN2 基因在溃疡性结肠炎患者结肠组织表达上升。
IBDMDB项目数据可通过https://ibdmdb.org/网站获得(图8)。
图8. IBDMDB数据库。(图源:https://ibdmdb.org/)
2型糖尿病
(Type 2 diabetes mellitus, T2D)项目
2型糖尿病是一种代谢紊乱疾病,可以起肾病、性视网膜病变和心血管疾病等并发症,全球受累及人口约4亿。
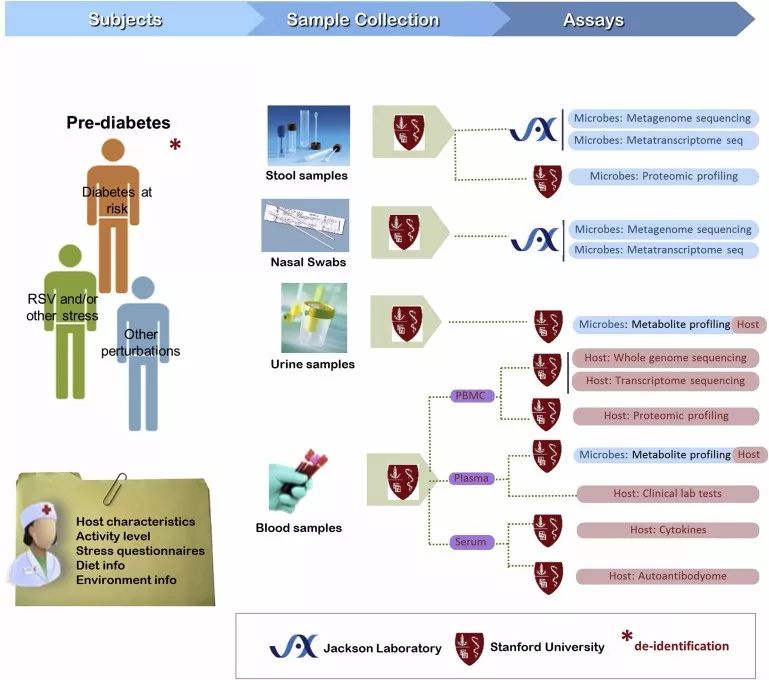
图9. T2D项目的参与团队及研究流程。(图源:参考文献5)
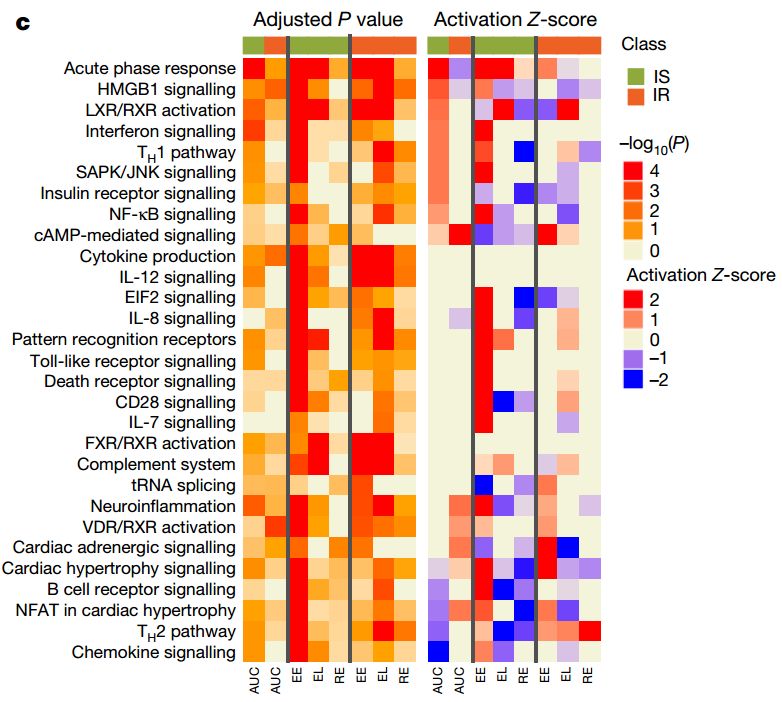
在 T2D 研究项目中,斯坦福大学联合杰克逊实验室对106名参与者进行了为期4年的跟踪随访,采集了血液、粪便和鼻拭子等样本进行多组学分析,并检测了不同人群对环境应激(呼吸道病毒感染)或医疗干预(免疫接种)的反应(图9)。结果显示,健康个体和前驱糖尿病(prediabetes)个体在菌群变化、免疫反应、新陈代谢等方面存在差异。例如,胰岛素抵抗(insulin-resistance)个体对呼吸道病毒感染的免疫反应相对滞后(图10)。该研究还发现了数百个与2 型糖尿病发病相关的分子,例如白介素-1受体激动剂(IL-1RA)和高敏感C反应蛋白(HSCRP)等。
图10. 不同个体对呼吸道病毒感染引起的免疫反应存在差异。IS:胰岛素敏感个体;IR:胰岛素抵抗个体。(图源:参考文献4)
该研究从人体和微生物两个角度全面绘制了更为全面和动态化的多组学图谱,可以让我们从个体水平研究疾病发生早期的分子变化。
iHMP 研究联盟在同期《自然》发表观点文章称,持续十余载的HMP为微生物组学研究提供了可供参考的合作模式,所获得的海量数据为未来揭示疾病状态下人类-微生物相互作用机制提供了丰富的资源和广阔的平台 [6]。
HMP前项目协调员 Lita Proctor 表示,未来微生物组学研究需要进行数据的标准化,提高结果的可重复性,并且随着组学研究领域经费投入的加大,多部门协调和多学科合作显得尤为重要 [1]。

[1] Lita Proctor, What’s next for the humanmicrobiome? Nature 2019; 569: 623-625. DOI: 10.1038/d41586-019-01654-0
[2] Jennifer M. Fettweis, Myrna G. Serrano, J.Paul Brooks, et al., The vaginalmicrobiome and preterm birth. Nature Medicine 2019; doi.org/10.1038/s41591-019-0450-2
[3] Jason Lloyd-Price, Cesar Arze, Ashwin N.Ananthakrishnan, et al., Multi-omicsof the gut microbial ecosystem in inflammatory bowel diseases. Nature 2019;569: 655-662. doi.org/10.1038/s41586-019-1237-9
[4] Wenyu Zhou, M. Reza Sailani, Kévin Contrepois,et al., Longitudinal multi-omics ofhost–microbe dynamics in prediabetes. Nature 2019; 569: 663-671. doi.org/10.1038/s41586-019-1236-x
[5] https://www.hmpdacc.org/ihmp/overview/data-model.php
[6] The integrative HMP (iHMP) research Networkconsortium, The Integrative Human Microbiome Project. doi.org/10.1038/s41586-019-1238-8
制版编辑 | 皮皮鱼
更多精彩文章:
点击“阅读原文”,与知识分子一起悦读2019。