小分子-膜蛋白质互作界面和结构调控分析研究获进展
近日,中国科学院大连化学物理研究所生物分子结构表征新方法创新特区研究组研究员王方军团队与中科院神经科学研究所研究员竺淑佳团队合作,在N-甲基-D-天冬氨酸受体(NMDARs)-小分子配体相互作用机制分析方面取得新进展,相关结果作为Back Cover在Chemical Communications上发表。
在生理条件下蛋白质中的赖氨酸一般带正电荷,与邻近氨基酸残基间的静电相互作用、氢键等是调节蛋白质结构和相互作用的关键因素之一。赖氨酸反应性与其所处微观环境密切相关,蛋白质结构和相互作用的变化直接影响相关区域赖氨酸的反应性。王方军等人在2016年提出了活性蛋白质复合物二甲基化共价标记策略,根据赖氨酸侧链氨基标记效率实现了对赖氨酸反应性的定量分析,以及对赖氨酸近程微环境的动态监测(Anal. Chem.,2016)。该方法是一种分析蛋白质互作界面和结构变化的质谱新方法,与传统氢氘交换、羟基自由基氧化等质谱方法相比具有稳定性好、标记效率和特异性高、数据处理简单等优点,可以应用于蛋白-蛋白、蛋白-小分子等生物分子互作界面和结构调节分析。
在此工作的基础上,王方军等人进一步实现了基于定量赖氨酸反应性变化的蛋白受体结构调节机制质谱分析,对小分子配体托卡朋和儿茶酚-O-甲基转移酶(COMT),以及Ro25-6981,Gavestinel,UBP710和膜蛋白受体NMDARs的相互作用分子机制进行了系统研究,证明了该方法不仅可以发现小分子与蛋白质的直接作用区域,还可以监测蛋白质产生了构象变化的其它区域。NMDAR复合物是阿尔茨海默症、抑郁等疾病的潜在治疗靶点。解析小分子与膜蛋白受体的相互作用机制目前仍然面临巨大挑战,是小分子药物开发中的难点之一。该方法为研究小分子-膜蛋白受体分子识别和结构调节机制提供了一种有效的质谱分析新方法,有望应用于靶向小分子药物的筛选、评估和优化。
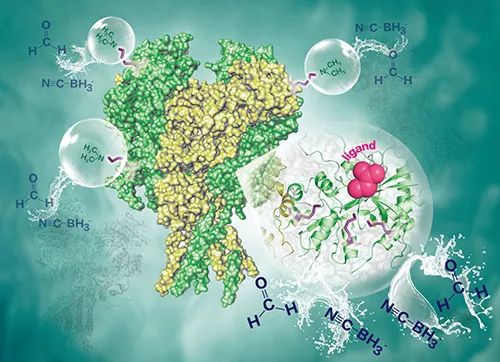
小分子-膜蛋白质互作界面和结构调控分析取得新进展
来源:中国科学院大连化学物理研究所
温馨提示:近期,微信公众号信息流改版。每个用户可以设置 常读订阅号,这些订阅号将以大卡片的形式展示。因此,如果不想错过“中科院之声”的文章,你一定要进行以下操作:进入“中科院之声”公众号 → 点击右上角的 ··· 菜单 → 选择「设为星标」





