(一)CLL的临床特点与诊断依据:
【徐卫教授】慢性B淋巴增殖性疾病诊断与鉴别诊断专家共识
整理:肿瘤资讯小编 蔬菜
慢性B淋巴增殖性疾病(B-CLPD)的共同临床特点是:多发于老年人,临床进展缓慢,呈低度恶性[套细胞淋巴瘤(MCL)除外],可向侵袭性淋巴瘤转化。形态学特点为:以小的成熟淋巴细胞为主,部分可以出现中等大小淋巴细胞。免疫表型:表达B细胞相关抗原(CD19、CD20、CD22、CD79α)和膜表面免疫球蛋白(sIg)单一轻链(κ或λ)。基因重排特点为:免疫球蛋白重链(IgH)或/和轻链(IgL) 基因重排。
南京医科大学第一附属医院(江苏省人民医院)血液科副主任
任江苏省血液学会副主任委员
中国抗癌协会血液肿瘤专业委员会委员兼秘书长
中国老年医学学会血液学分会常委
CSCO中国抗淋巴瘤联盟委员等职务
江苏省“兴卫工程”优秀医学重点人才、“青蓝工程”中青年学术带头人培养对象
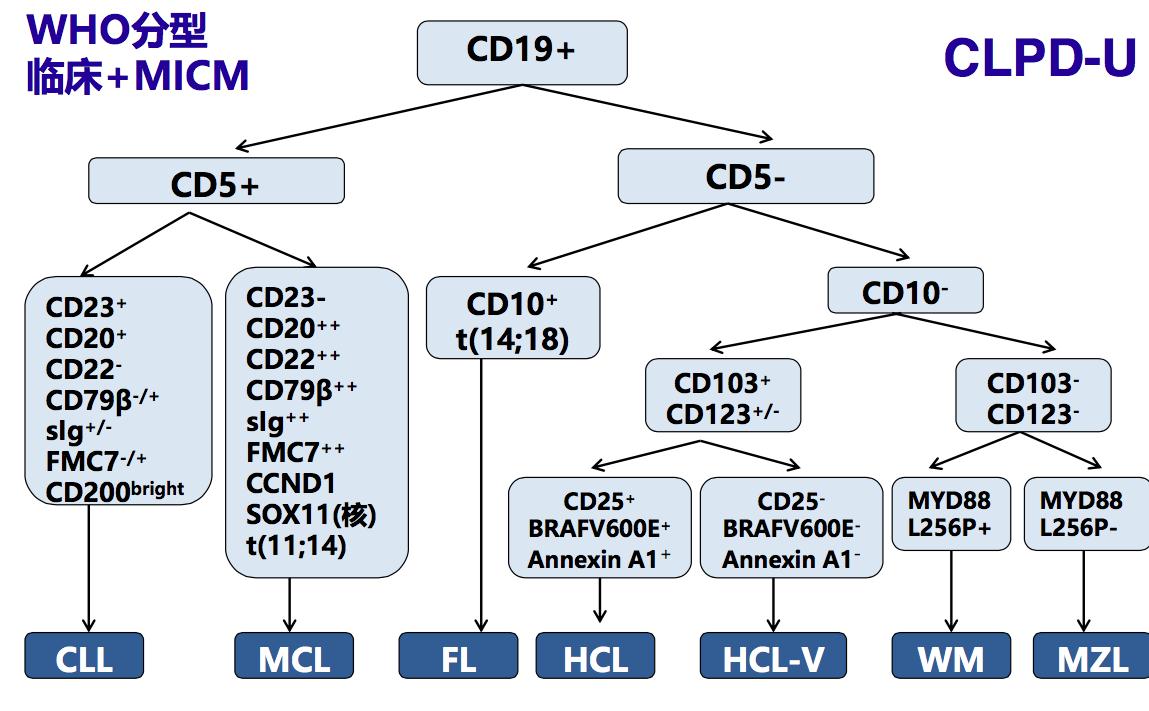
在B-CLPD的诊断主要根据临床表现与及MICM结果。在诊断与鉴别诊断中需要完善并重点鉴别以下检查结果:骨髓涂片、活检及IHC;FCM免疫表型及表达强度;常规细胞遗传学/FISH;分子生物学指标。根据WHO分型将B-CLPD分为以下常见7种B-CLPD亚型与及不能分类的慢性B淋巴增殖性疾病(B-CLPD-U)。
以下对B-CLPD各种亚型的临床特点与诊断标准,与及该病在2016年WHO的更新内容进行具体介绍。
一、 慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)
1、CLL中外周血单克隆B淋巴细胞数对诊断的意义:外周血单克隆B淋巴细胞≥ 5×109/L可诊断CLL。而在外周血单克隆B淋巴细胞<5×109/L,无髓外病变,即使出现血细胞少或疾病相关症状,也不能诊断CLL。
2、CLL FCM免疫表型:CD5+,CD23+,CD22+(dim),FMC7-, sIg+(dim)部分病例可表现为:sIg+(强),CD23-/+,FMC7+。
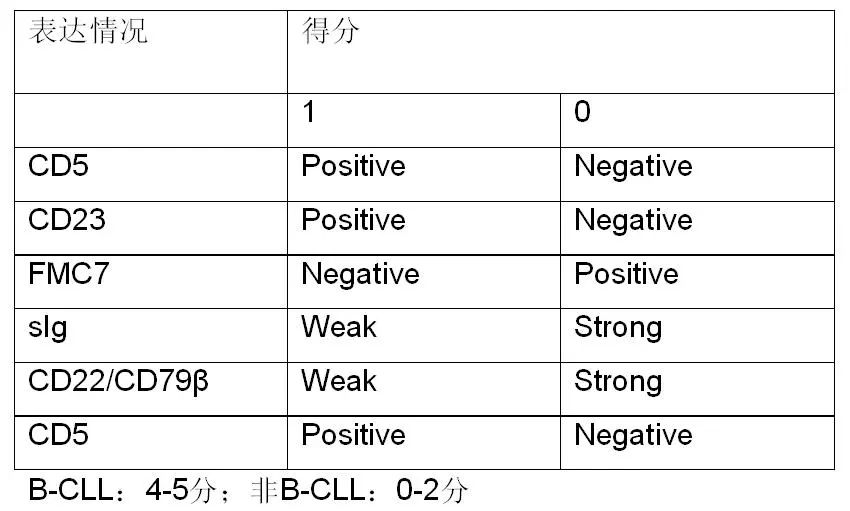
CLL/SLL积分系统:
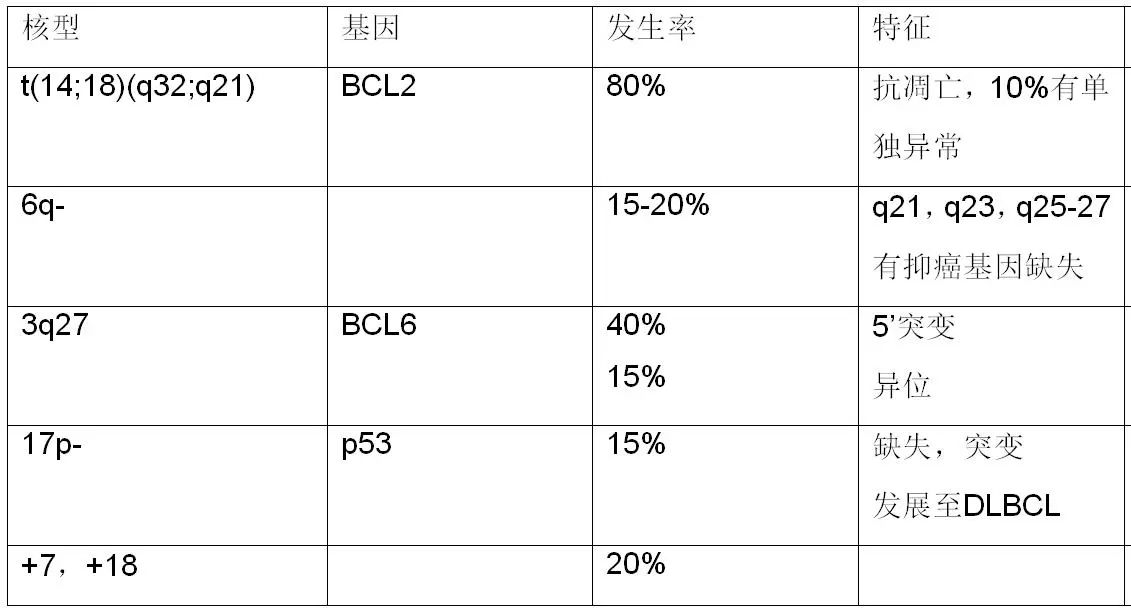
3、CLL/SLL遗传学异常:
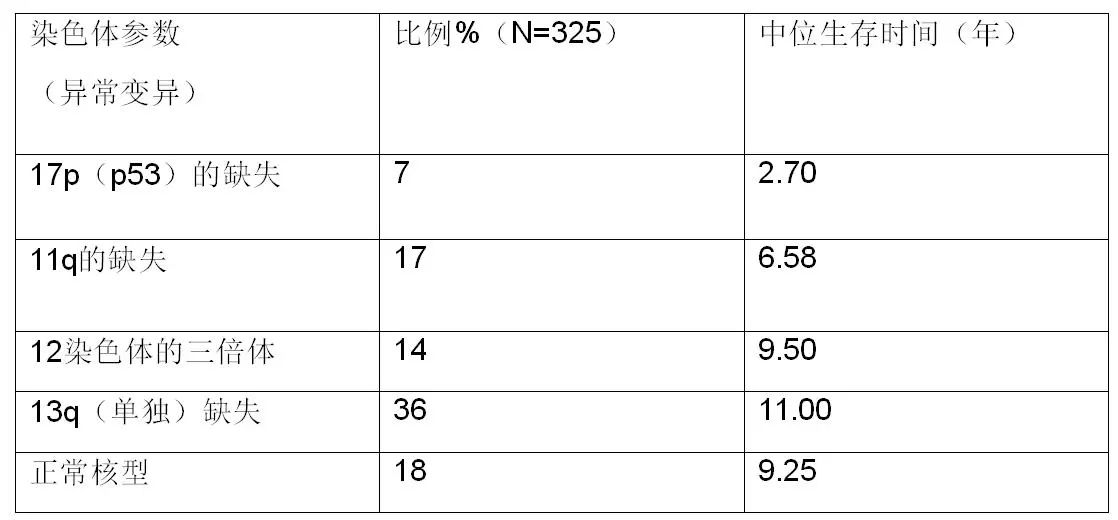
80%的患者伴有遗传学异常:del(13q14):50%;trisomy 12: 20%;del(11q22-23): 20%; IgH易位: 10-20%;del(17p13): 10%;del(6q23): 5%。
CLL遗传学异常与预后相关:
4、增殖中心的概念及意义:
在CLL/SLL中,强调了增殖中心(PC)的概念。PC表达cyclin D1、MYC蛋白但缺乏相应的基因易位或拷贝数改变。较大/融合的PC或者具有高增殖指数通常提示着较差的预后。具有较多PC的CLL/SLL与其他CLL/SLL相比,通常具有更多的17p-或者11q-等不良遗传学异常,并且预后较差。
(二)CLL——2016 WHO更新
1、“加速期”CLL
2016年WHO分类提出了“加速期”CLL及相应的组织学标准:排除Richter转化的情况下,具有扩张的PC并且具有较高的增殖指数(PC中Ki67>40%)。其意义在于“加速期”CLL的临床预后显著差于“非加速期”CLL,临床上可能需要更加积极的干预。
2、CLL遗传学异常
分子生物学的进展:TP53、NOTCH1、SF3B1、ATM、 BIRC3是预后差的指标;部分可作为潜在的治疗靶点;可与经典的重现性染色体异常结合,用于危险因素评估。
3、单克隆B淋巴细胞增多症(MBL)
MBL见于12%健康人,诊断标准为外周血单克隆B细胞<5×109/L;免疫表型:CLL、atypical CLL、non-CLL表型,数量可非常少或增多。与CLL的关系:2016 WHO明确指出CLL样的MBL是CLL的前驱病变。
MBL在2016年分类中的变化:诊断标准不变,强调数量的划分。数量低:< 0.5×109/L,无进展风险、无需常规随访。数量高:≥ 0.5×109/L,需要常规随访,与Rai 0期CLL相似,包括表型和遗传/分子特征等,年进展率为1%。部分non-CLL表型的MBL与SMZL密切相关。并且提出组织学概念上的MBL是指侵犯LN,无增殖中心,肿块<1.5cm,极少进展的这一类疾病。
二、 套细胞淋巴瘤(MCL)
(一)MCL的发病特点与诊断依据
1、发病特点:80%患者诊断时即处于晚期(III/IV),90%常伴随结外播散病灶(GI、骨髓),80%外周血存在MCL细胞(FCM检测比例更高,92%);80-90%胃肠道累及(结肠淋巴瘤样息肉病,结肠受累);常规结肠镜检查(治疗前评估及治疗后疗效观察)。
2、MCL的细胞形态为小至中等大小细胞带有轻微不规则的核。
3、MCL FCM免疫表型特点为:CD5+,cyclin D1+,同时表达CD19、CD20、CD22和 CD79β等。CD20、sIg和CD79β表达比CLL强。大多数CD23阴性(25%弱阳性);CD11c阴性(诊断价值高于CD23)。CD23在鉴别诊断MCL与CLL中的价值:CLL:>92.5%和/或MFI>44.5;MCL:<30%;CLL/MCL:30%~92.5%和MFI<4。CD148/CD200鉴别诊断MCL与CLL的价值:CD148在MCL中的表达高于CLL,CD200在MCL中表达低于CLL。
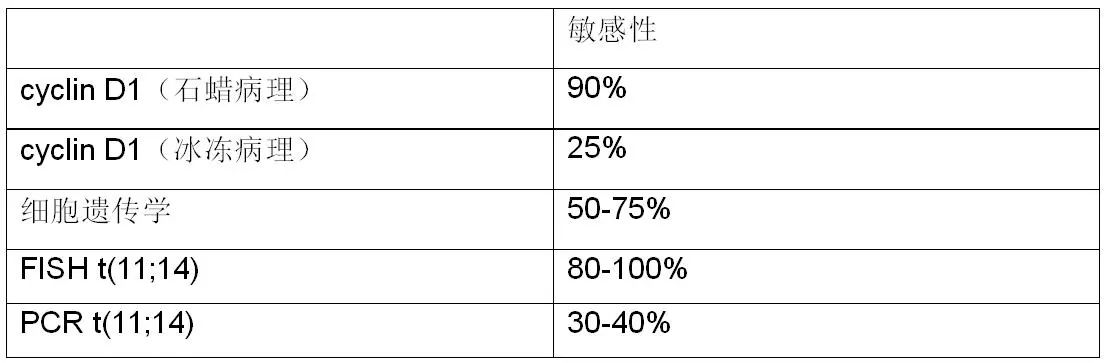
4、特征性遗传学异常t(11;14)(q13;q32)
cyclin D1阴性的MCL:高通量研究表明cyclin D1在7%MCL中阴性,所以cyclin D1表达并非诊断MCL必不可少的条件。SOX11表达是cyclin D1的重要补充,因为在MCL细胞核SOX11蛋白的表达远远高于CLL。
(二)MCL——2016 WHO更新
1、确认了MCL两种不同临床病理特征和分子致病途径:①无或有微小IGHV突变、 SOX11+;②有IGHV突变、SOX11-(惰性白血病样非淋巴结MCL)。
2、惰性白血病样非淋巴结MCL的特点为:IGHV有突变、SOX11-;常侵犯外周血、骨髓和脾脏;Ki67<10%;PET-CT SUVmax<6;临床呈惰性,一旦发生继发性、累及TP53的遗传学异常则具有侵袭性。
3、MCL分子生物学改变
1)非随机性继发性染色体获得/缺失和重现性拷贝中性杂合性缺失(copy-neutral loss of heterozygosity),后者常累及同一区域,如TP53;
2)最常见的基因突变:ATM(40%-75%)、CCND1(35%)、其他突变<15%(包括NOTCH1和 NOTCH2);
3)约1/2 CCND1阴性患者具有CCND2易位,伙伴基因 常为IGK或IGL,可用于诊断。
三、滤泡淋巴瘤 (FL)
(一)FL的发病特点与诊断依据
1、发病特点:20岁以下的人罕见;淋巴结无痛性逐渐增大(颈、腹股沟、腋窝),脾脏、骨髓、外周血和口咽环常累及胃肠道、皮肤和软组织也可累及,2/3以上患者为临床III-IV期。
2、细胞来源:生发中心B细胞。
3、FL FCM免疫表型:表达全B细胞标记CD19、CD20、CD22、CD79α、FMC7和生发中心抗原CD10、BCL2、BCL6,CD20荧光强度强于正常淋巴细胞,部分患者CD23阳性,CD5-。
4、 FL的遗传学异常:Ig基因重排;IGHV基因常有突变
(二) 滤泡淋巴瘤(FL) ——2016 WHO更新
染色质调节因子/修饰基因,如CREBBP和KMT2D(MLL2)突变是常见的早期事件,可作为潜在治疗靶;EZH2突变(占FL的20%-25%)为另一早期事件,也是潜在治疗靶点;尚有大量其他基因突变,但发生率显著低;突变分析是否作为诊断、预后、治疗的常规与及是否与其他病理和临床预后因素相结合仍待确定。
四、边缘区淋巴瘤(MZL)
结节边缘区B细胞淋巴瘤与慢性感染、自身免疫性疾病有关;发生部位概率:胃肠道50%,肺14%,头颈14%,眼附属器12%,皮肤 11%,甲状腺4%,乳腺4%。典型的免疫表型: sIgM(轻链限制性)+、CD19+ 、CD20+、CD79α+、CD5-、CD10-、CD23-、 CD43±、CD11c±、CD21+、CD35+、cyclin D1-。
脾边缘区淋巴瘤(SMZL)
(一)SMZL的发病特点与诊断依据
1、SMZL发病特点:CD5-的难以分类的B-CLPD中大多为此类疾病;常伴巨脾,侵犯脾白髓的生发中心、脾门淋巴结,骨髓、外周血常受累[细胞胞膜边缘常伴有绒毛状突起] ,浅表淋巴结和结外组织罕见受累,1/3有血清单克隆Ig。侵犯骨髓的方式常为小梁旁或窦内侵犯而很少为小梁内侵,在南欧发现与HCV感染相关。
2、SMZL细胞形态学:外周血常可见绒毛状淋巴细胞。
3、SMZL免疫表型:无特异性抗原表达(排除性诊断):sIgM/D+、CD20+、CD79α+、 bcl-2+、CD43-。
– CD5-和CD23-(与CLL/SLL鉴别)
– CD10-和 BCL6-(与FL鉴别)
– CD5-和Cyclin D1-(与MCL鉴别)
– CD103-和Annexin A1-(与HCL鉴别)
– 约5~10%的患者CD5+
4、SMZL的最低诊断标准
1)脾组织学+CLL免疫表型积分≤2分,能获得脾组织学时,典型血液和骨髓形态学+免疫表型+骨髓窦内CD20阳性细胞浸润,因此脾肿大患者,如不能获得脾组织学时,典型的血液和骨髓表现足以诊断。
2)SMZL遗传学异常:7q21-32缺失占40%以上;+3异常占17%;IGVH1–2(31%)、IGVH4–34(13%)、IGVH3–23(8%);NOTCH2突变占25%。
五、淋巴浆细胞淋巴瘤(LPL)/ 华氏巨球蛋白血症(WM)
(一)LPL/WM的临床特点与诊断依据
1、LPL/WM临床特点:LPL是由小B细胞、浆细胞样淋巴细胞和浆细胞组成的恶性肿瘤,以骨髓或肝、脾、淋巴结内淋巴浆细胞浸润。WM是骨髓中有浆样淋巴细胞浸润(不管量的多少),血清中存在单克隆lgM(不管量的多少)。
2、WM细胞遗传学异常:del 6q21-25最常见,占30~50%,家族聚集性病例和分散性病例均可见;IgH易位罕见,是与IgM型MM鉴别的要点之一;MYD88 L265P突变是WM最常见的基因突变。
(二) LPL/WM----2016WHO更新
1、 肯定了MYD88 L265P突变对LPL/WM诊断价值,尽管在IgM型MGUS和其他B细胞淋巴瘤中也阳性。
2、 相比于MM,IgM型MGUS与LPL/WM关系更密切;CXCR4突变可见于30%的LPL和20%的IgM型MGUS;IgG和IgA型MGUS中无此突变。
六、毛细胞白血病(HCL)
(一)HCL的临床特点与诊断依据
1、临床特点:以脾肿大、全血细胞少为主要表现(70%-90%);单核细胞减少(<100/ uL)为特征性表现。
2、细胞形态为毛细胞,侵犯脾红髓,BM活检HCL细胞形态学:煎鸡蛋样改变;抗酸石酸性磷酸酶颗粒状强阳性。
3、HCL FCM免疫表型:CD19+、CD20+(strong)、CD22+(strong)、 CD79α+、 CD5-、CD10-、CD23-、 CD11c(strong)、CD25+、CD103+、CD123+、 FMC7+;Annexin A1+(IHC,最特异性标记,其他B细胞淋巴瘤均为阴性)。
4、HCL vs HCL-v
HCL-v伴有白细胞增多,单核细胞增多,细胞中有隆凸的核,并且CD25、Annexin A1和TRAP阴性。
(二)HCL--2016 WHO更新
1、几乎所有HCL都具有BRAF V600E突变,但HCL-v和其他小B细胞淋巴瘤无此突变。
2、MAP2K1突变(编码MEK1,位于BRAF下游)存在于约 1/2HCL-v,和绝大多数IGHV4-34使用、但无BRAF V600E突变的HCL中。
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情