研究人员揭示神经发育必需因子及其作用机制
近日,中国科学院遗传与发育生物学研究所杨崇林研究组和郭伟翔研究组的联合研究论文,发表在 The Journal of Cell Biology 上。论文揭示了一个新的神经发育的关键蛋白-WDR91,并阐明了其作为小 GTP 酶 Rab7 效应因子在溶酶体运输通路中发挥重要作用。
内吞体-溶酶体运输调控细胞内信号转导、细胞膜修复、细胞迁移和神经轴突生长等过程,对于维持细胞稳态和发育至关重要。其中,早-晚期内吞体的转换是内吞体-溶酶体运输的关键环节。早-晚期内吞体的转换需要将早期内吞体上的特征性小 GTP 酶 Rab5 和磷脂酰肌-3磷酸(PtdIns3P)转换为晚期内吞体上的特征性小 GTP 酶 Rab7 和磷脂酰肌-3,5二磷酸((PtdIns(3,5)P2)。杨崇林研究组的前期研究发现了线虫中的两个蛋白 SORF-1 和 SORF-2,它们相互作用并与内吞体上磷脂酰肌-3磷酸激酶(PI3K)复合体互作,从而抑制 PtdIns3P 的合成,促进早-晚期内吞体转化。SORF-1 和 SORF-2 的人类同源蛋白 WDR91 和 WDR81 以同样机制发挥作用。
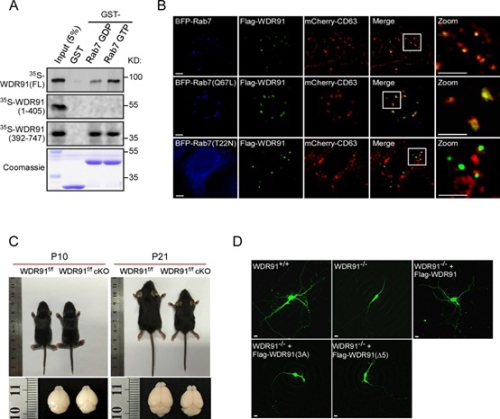
杨崇林研究组和郭伟翔研究组合作发现,WDR91 通过其C-端与活化形式的小 GTP 酶 Rab7 结合,从而被招募到内吞体上。同时,WDR91 通过其N-端与 PI3K 复合体的 Beclin1 亚基相结合。WDR91 因而特异地在内吞体上抑制 PI3K复合物的活性,使内吞体转换所需要的 Rab5-Rab7 转换与 PtdIns3P-PtdIns(3,5)P2 转换同步进行。Wdr91 敲除小鼠在出生后几个小时内死亡。在脑组织中特异性敲除 Wdr91 后,小鼠表现为大脑发育异常,在出生3至4周后死亡。在缺失 Wdr91 的原代神经元中,有大量异常增大的内吞体存在,神经元树突的长度和复杂度均显著降低。这些内吞体缺陷和神经发育缺陷可被野生型 WDR91 蛋白恢复,但却不能被与 Rab7 结合的有缺陷的 WDR91 突变蛋白恢复。研究表明,WDR91 是 Rab7 的一个新的效应因子,在对神经元的发育中发挥不可或缺的作用。
研究工作受到国家重点基础研究发展计划、国家自然科学基金委、中科院跨学科创新团队、中科院前沿科学研究重点项目的资助。
A.WDR91 与活性形式 GTP-rab7 的相互作用。B.WDR91 被野生型 Rab7 或持续活化的 GTP-Rab7(Q67L) 招募到内吞体上。C.脑组织特异性敲除 Wdr91 小鼠的大脑发育异常。D.野生型 WDR91 而非 Rab7 结合缺陷性的 WDR91 突变体使缺失 Wdr91 的异常原代神经元恢复为正常。
来源:中国科学院遗传与发育生物学研究所