背景
【JAMA Oncol】连续的ctDNA检测有助于识别免疫治疗的真假进展
免疫治疗因其特殊的作用机制,会出现独特的疗效反应,如“假性进展”。预计在接受免疫检查点抑制剂治疗的患者中,约10%的患者会出现假性进展。识别真假性进展,将为临床治疗决策提供重要参考。近期发布在《JAMA Oncology》的研究提示,ctDNA动态变化谱有助于识别患者为真性还是假性进展。
PD-1抑制剂单药或联合ipilimumab已经成为转移性黑色素瘤的标准治疗方案。既往的研究显示,在接受抗PD-1单抗治疗的黑色素瘤患者中,基线或治疗8周内检测不到血浆ctDNA,预示着患者的治疗疗效更好,且预后更佳。假性进展,是指患者在治疗后出现新发病灶或靶病灶体积增大,在接受PD-1单抗治疗的患者中发生率超过10%。要确定患者是否为假性进展,需要后续进行影像学检测进一步确认,目前识别假性进展仍然是临床一大难题,尽管提出了免疫相关疗效评价标准(irRC)。本研究中,作者对接受PD-1单抗治疗的黑色素瘤患者进行基线或治疗早期ctDNA的监测,评估其能否区分免疫治疗的真性或假性进展。
方法
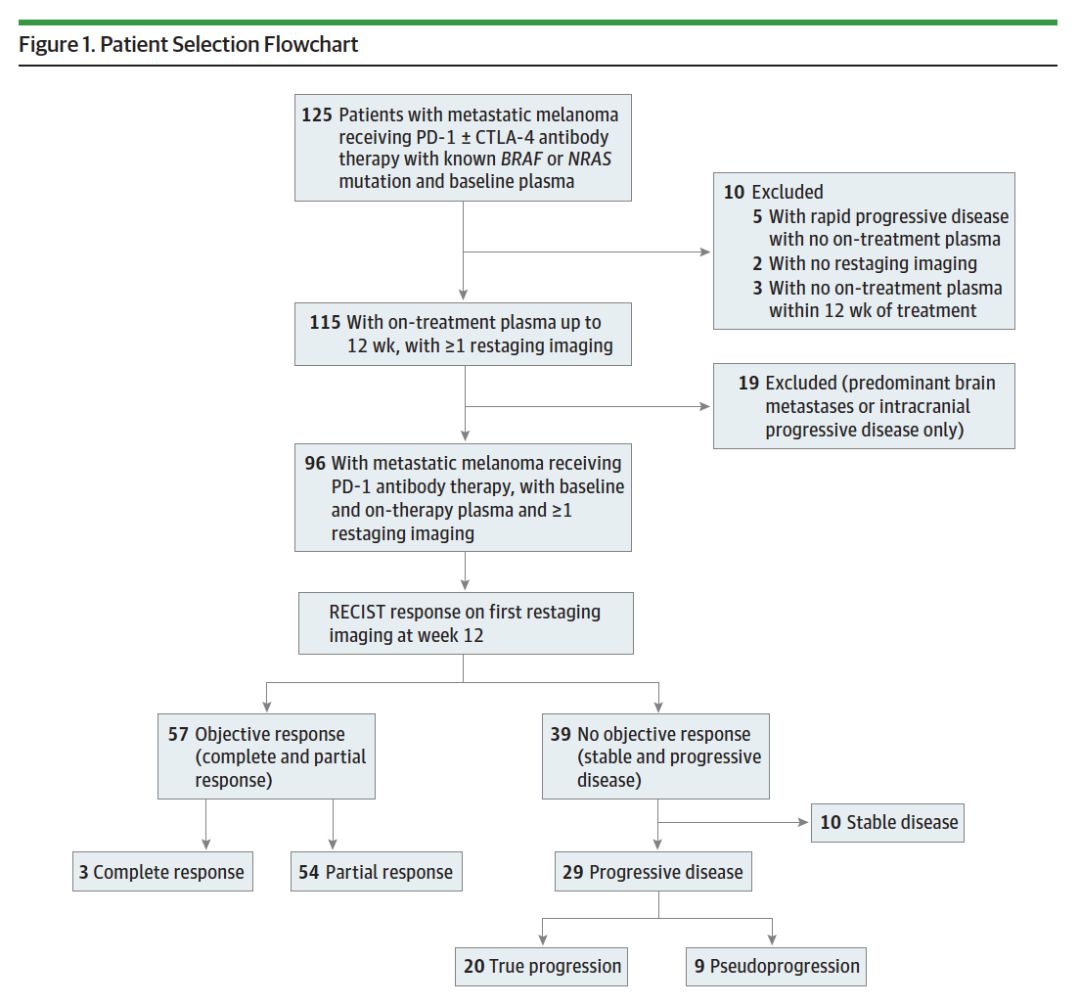
研究入组了2014年6月至2016年5月,合并BRAF或NRAS基因突变,并接受pembrolizumab或nivolumab联合或不联合ipilimumab治疗的IV期黑色素瘤患者。患者入组流程图见下图1。采用RECISIT 1.1标准对患者进行回顾性的疗效评价。此外,研究者同时采用irRC进行疗效评价,假性进展定义为第一次影像学评估(第12周)时肿瘤负荷增加25%,但在第二次评价中疾病进展没有得到确认。
图1.研究入组流程图.
分别在基线和治疗间期规律的收集患者的外周血标本。根据患者ctDNA变化谱分为两类:1. 良性ctDNA变化,定义为基线和治疗过程中均未检测到ctDNA或基线可以检测到ctDNA,但是治疗过程中无法检测到或ctDNA浓度下降至少10倍;2. 恶性ctDNA变化,定义为基线可检测到ctDNA且治疗过程中ctDNA浓度保持稳定或增加。
结果
1. 患者的临床特征
研究共入组125例患者,其中29例患者在第一次疗效评价时,疾病出现进展。这29例患者中,17例(59%)患者年龄<=65岁,18例(62%)为男性。中位随访周期为84周,截至最后随访日期,29例患者中,仍有13例(45%)患者存活。真性进展的患者20例(69%),假性进展的患者9例(31%)。
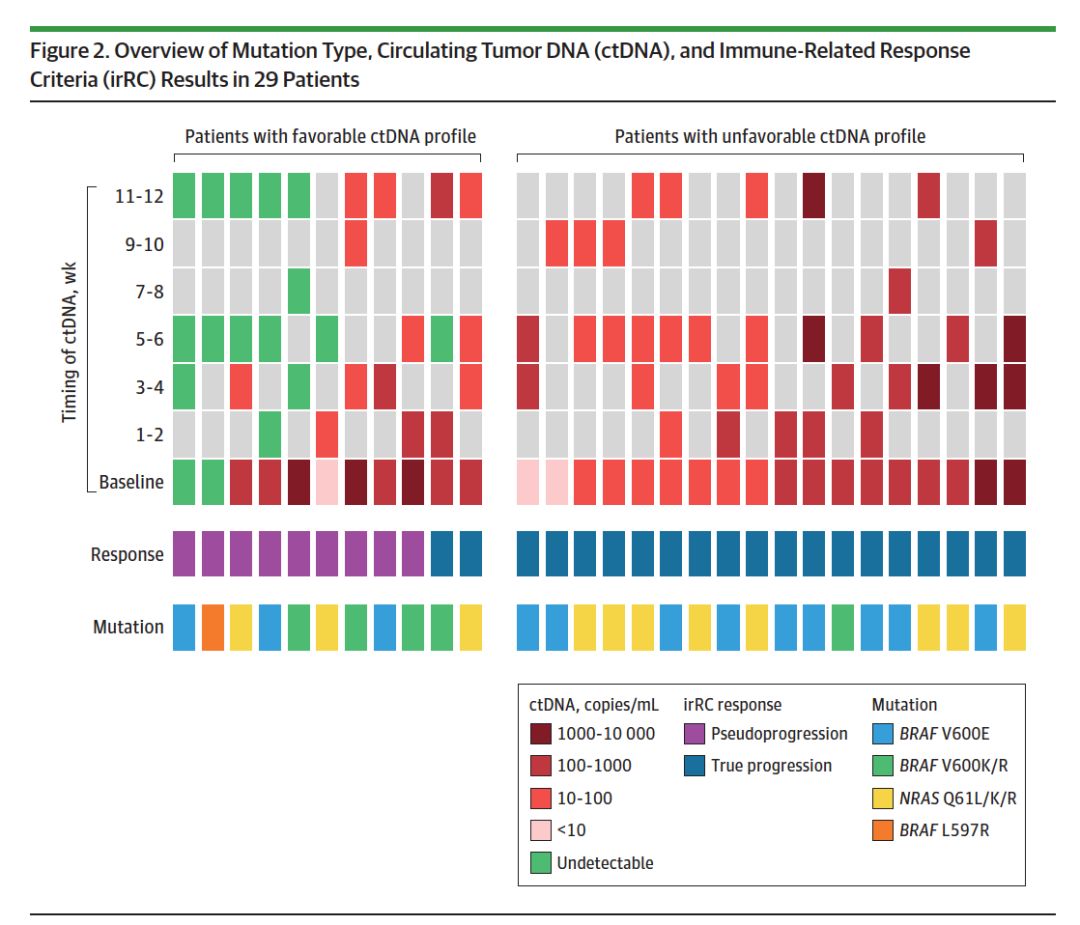
29例患者中,11例(38%)患者观察到良性ctDNA变化。其中2例(18%)患者在基线时检测不到ctDNA,5例(45%)患者基线时可以检测到ctDNA,但6周后ctDNA浓度下降到无法检测,4例(36%)患者在12周时仍可以检测到ctDNA,但浓度下降至少10倍,变化情况如下图2.
2. 假性进展的患者
9例假性进展的患者,ctDNA变化谱均为良性:2例(22%)患者基线时无法检测到ctDNA,4例(44%)患者基线时可以检测到ctDNA,但治疗后下降到无法检测,3例(33%)患者12周后ctDNA浓度下降大于10倍,总结见下图2。这9例患者,其中3例(33%)患者分别在治疗后30周,43周和78周进展;2例患者分别在治疗后110周和128周死于疾病进展。在30周和43周出现疾病进展的2例患者,12周内的ctDNA浓度虽然下降10倍以上,但仍能检测到。
图2. 患者的ctDNA变化谱和疗效的关系
3. 真性进展的患者
20例患者为真性进展的患者,其中18例(90%)患者ctDNA变化谱属于恶性,见图2. 截至最后随访日期,20例患者中,6例(30%)仍然存活:其中2例(33%)患者进展部位进行了完全切除;剩余4例(67%)患者为BRAF突变的患者,接受了挽救性的MAPK抑制剂治疗。真性进展的患者,中位总生存为41周。
进一步分析2例真性进展,但ctDNA变化谱属于良性的患者。其中1例患者在第12周评价时靶病灶缓解,但出现新的坏死的淋巴结(irRC评价为缓解)。基线可以检测到ctDNA,6周时ctDNA下降到无法检测,但12周时又能继续检测到。这1例患者属于良性ctNDA变化,因为6周时患者到ctDNA下降为0。12周时患者到ctDNA再次升高,提示其为真性进展,第27周影像学评估进一步确认了患者为真性进展。第2例患者接受了联合免疫治疗,尽管ctDNA浓度较基线下降10倍以上,但疾病进展,治疗第12周后换用MAPK抑制剂。
4. 患者的总生存分析
采用ctDNA变化谱来识别假性进展的敏感度为90%,特异性为100%。而采用LDH变化谱来识别假性进展的敏感度为60%,特异性为89%。因此,ctDNA变化谱较LDH有更高的阳性预测值(100% vs 92%)和阴性预测值(82% vs 50%)。
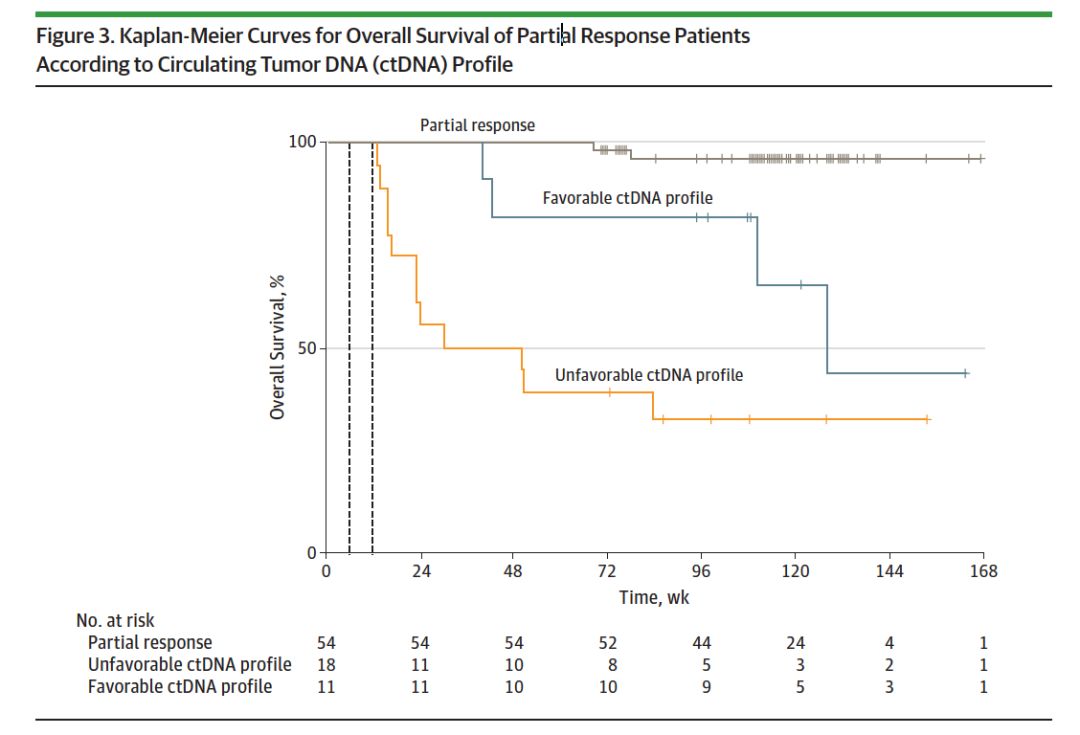
根据第6周的ctDNA变化谱来预估良性和恶性变化患者的总生存,HR为3.9,P=0.02;根据第12周的ctDNA变化谱来预估良性和恶性变化患者的总生存,HR为3.3,P=0.03. 在ctDNA变化谱属于良性的患者中(125例),取得部分患者的患者较疾病进展的患者,总生存更优(HR=0.09;95%CI:0.01-0.80;P<0.001)。取得PR的患者1年生存率为100%,良性和恶性ctDNA变化谱患者1年生存率分别为82%和39%,三组的总生存对比如下图3所示。
图3. CtDNA变化谱与患者总生存的关系
结论和讨论
这一研究结果提示,ctDNA变化可以为临床治疗决策提供重要参考。后续新的临床研究可以考虑根据ctDNA变化来判断患者是否应该继续治疗。但这一研究进展黑色素瘤患者中进行探索,后续还需在更多瘤种患者中进行进一步的验证。
Association Between Circulating Tumor DNA and Pseudoprogression in Patients With Metastatic Melanoma Treated With Anti–Programmed Cell Death 1 Antibodies. JAMA Oncol. doi:10.1001/jamaoncol.2017.5332 Published online February 8, 2018.
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情