不用精子就能繁育后代,科学家只用1个卵细胞就培育出健康小鼠,来自上交医学院 | PNAS
明敏 萧箫 发自 凹非寺
量子位 | 公众号 QbitAI
你敢信,现在只用1个卵细胞,就能“生”出健康小鼠了!
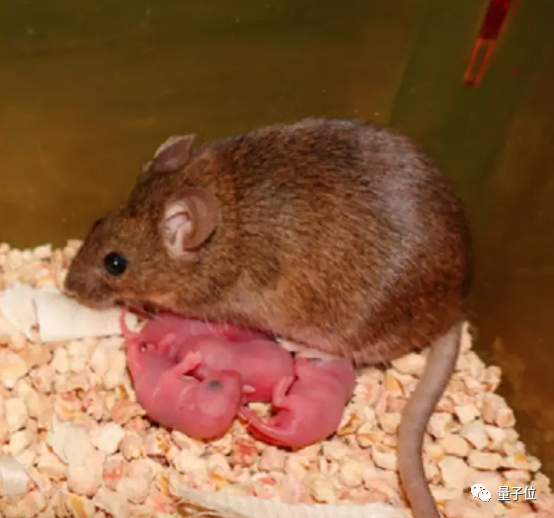
科学家们现在通过一些特殊方法,用单个卵细胞就能创造出健康的小鼠。
生下来的小鼠不仅活到了成年,还有了自己的后代。
△成年小鼠和它的健康后代
这种现象被称为孤雌生殖,此前一直没能在哺乳动物中真正实现。
孤雌生殖在爬行动物或某些鱼虫鸟类中比较常见,哺乳动物此前虽然用2个卵细胞实现过同性繁殖,但单个细胞还没有成功过。
这篇最新的研究来自上海交通大学医学院附属济仁医院等单位,目前已经发表在《美国国家科学院院刊》(PNAS)上。
来看看科学家们是怎么完成这一突破的。
用基因编辑模拟受精过程
事实上,孤雌生殖在自然界并不少见,但在哺乳动物身上却一直难以实现。
这是因为,生物细胞中的一些印记基因,会在正常受精过程中,让细胞中的某些等位基因1个表达而另1个不表达(正常来说应该都表达)。
也就是说,我们中学生物学的孟德尔遗传定律,在印记基因这里不适用,因为印记基因可能会让雌雄DNA在组合时,强行表达其中一方的基因。
这个过程,对于哺乳动物的胎儿生长非常关键:
印记基因对哺乳动物胎儿的生长和行为发育起着至关重要的作用,异常表达可能会导致个体出现过度生长、生长迟缓、智力障碍、行为异常等疾病。
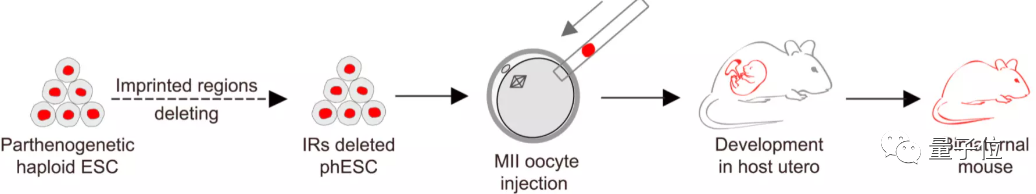
因此,要想让哺乳动物通过单个卵细胞生长存活,就需要通过基因编辑的方法,在卵细胞上模拟出受精卵的情况。
具体原理,就是利用甲基化酶和去甲基化酶,来让DNA中的某些基因表达,另一些基因沉默。
这是因为,基因的甲基化能影响转录过程,使得基因沉默。
如果能完成这些基因的甲基化或去甲基化,就能让卵细胞模拟出接受精子后的正常受精状态。
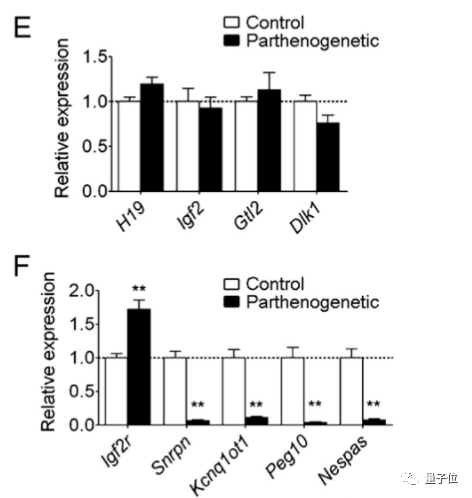
通过进一步研究,科学家们确定了7个需要被表达或沉默的基因,其中2个是父系基因组印记,5个是母系基因组印记。
其中,2个父系基因组印记H19和Gtl2在表达时,会出现抑制代谢活动、不生成蛋白质,从而让胚胎无法正常发育。
因此,研究团队使用CRISPR-dCas9通过Dnmt3a甲基化酶,将这两个基因的控制区域进行了甲基化。
而5个母系基因组印记控制区域Igf2r、Snrpn、Kcnq1ot1、Nespas和Peg10如果不表达,则会出现胚胎致死、或是严重影响其发育。
因此,研究人员又使用CRISPR-dCpf1通过Tet1去甲基化酶,实现了这5个基因控制区域的去甲基化。
当然,这些都还是理论,如果能完成这些基因的甲基化或去甲基化,就能让卵细胞模拟出接受精子后的正常受精状态。
具体实验结果究竟如何呢?
后代身体情况正常,可繁殖后代
在实验中,研究人员按照如上方法构建出了389个孤雌胚胎。
经过人工激活,其中227个为可培育的重构卵母细胞。
在体外培养后,有192个卵母细胞是可以正常发育到囊胚期,即胚泡。然后再将这些胚泡转移到了14只雌性小鼠体内。
最终,共产下了3只幼崽,其中2只体重过低,并表现出生长迟缓的迹象,在出生后24小时内死亡。
剩下1只幼崽体重正常,成功长到了成年期,还能正常繁殖后代,并且其体内的原发性印记障碍也不会遗传给下一代。
不过这只“幸运儿”在发育过程中,也同样表现出了生长迟缓的迹象,体重也比对照组低了19.8%。
研究人员发现,这只小鼠的Rasgrf1基因表达水平较低。
为了验证生长延缓和这一基因表达情况是否有关,研究人员对Rasgrf1进行了额外的甲基化编辑。
为此,他们培育了155个新型的孤雌胚胎,最后得到了2只小鼠后代。
结果显示,这两只小鼠在Rasgrf1基因表达正常,体重也与普通小鼠处于同一水平。
也就是说,Rasgrf1基因的表达确实会影响孤雌生殖小鼠后代的生长发育情况。
总之,这些实验数据可以表明,通过对多个ICR进行适当的表观遗传调控,就能在哺乳动物中实现孤雌生殖。
这一结论也符合亲本冲突假说,即父本、母本基因组印记的平衡,对于哺乳动物的发育至关重要。
至于为什么这一孤雌生殖方法只能培育出极少数的后代,研究人员给出了两点看法。
第一,可能是能够成功编辑基因的胚胎,并没有挑选出来的那么多;
第二,也可能是错过了其他重要的基因座,比如Grb10基因也被发现参与了繁殖过程。
在实际应用层面,这项研究为生殖繁育、遗传病研究开拓了道路。
目前,科学家们正在探索用基因编辑的方法治疗由单个基因调控的遗传病,比如囊性纤维化、血友病和镰状细胞病等。
另外还有希望用于治疗、预防癌症、心脏病、HIV方面。
这项研究同样也在网上引起了热议,震惊于这项研究成果的同时,大家也开始猜想它未来会在哪些领域发挥巨大作用。
不清楚这项研究对农业和医疗,会有多大帮助。
可以的话,不知道能不能实现两个单倍体玉米的繁育。
与此前研究有什么不同?
实际上,使用孤雌繁殖的方法来培育哺乳动物后代,科学家们早就有所尝试。
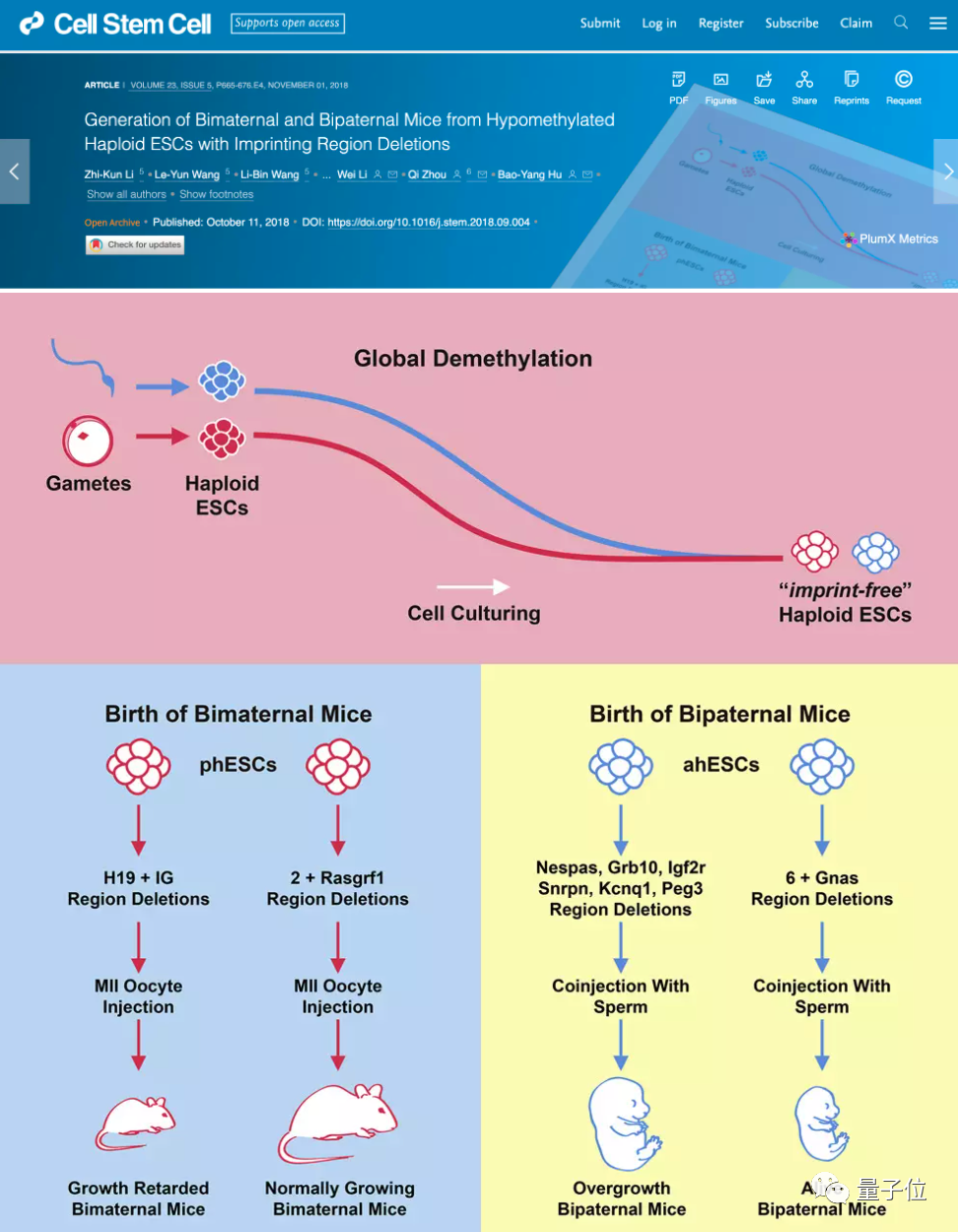
比如2018年中科院曾有一项发表在Cell Stem Cell上的研究,也是不依靠受精,就让小鼠完成了繁育。
最终得到的后代可以正常生长。
不过与最近的这项研究不同,中科院方面的工作是用上了两个卵细胞,也就是双亲繁殖。
原理还是利用了遗传印记。
实验中,研究人员通过删除遗传印记的方式,让卵母细胞中的母本特定基因正常表达。
这个过程可以被视为是一种“性别转化”,即模仿精子的行为。
然后,将完成转换的卵母细胞与另一只雌鼠的卵细胞结合,诱导胚胎发育成熟。
最终,研究人员培育的210个胚胎中,有29个小鼠出生,它们在发育、行为、代谢等方面都与普通小鼠无异,并有7只小鼠正常繁育下后代。
如此高的成功率,是因为中科院团队发现了单倍体胚胎干细胞中的基因组印记更少,潜在的影响也更容易消除。
利用CRISPR-Cas9,研究人员一共删除了3个遗传印记,分别是H19、IG和Rasgrf1。
这也解决了此前日本科学家在首次实现孤雌生殖时,繁育率过低、小鼠生长发育存在缺陷的问题。
△中科院团队培育出的双母小鼠及其后代
此外,中科院的科学家们还尝试了孤雄繁殖。
使用类似的方法,研究人员删除了雄性小鼠单倍体干细胞中的7个印记区。
随后他们将这一干细胞与另一精子结合,注射到去核卵细胞中,使后代基因完全来自两个“父亲”。
实验最终得到了12只孤雄生殖小鼠,虽然它们在出生后可以自主呼吸,但还是仅仅只存活了两天。
团队介绍
通讯作者为上海交通大学附属仁济医院副研究员魏延昌。
主要从事哺乳动物生殖与发育方面的研究。
曾在博士期间参与完成中国首批成体细胞克隆猪和绿色荧光蛋白转基因猪。
此前还在PNAS发表论文,发现父亲前期糖尿病可以通过雄性生殖细胞表观遗传的变化传递给后代,揭示了获得性性状遗传的关键分子机制;
论文地址:
https://www.pnas.org/doi/epdf/10.1073/pnas.2115248119
参考链接:
https://m.thepaper.cn/yidian_promDetail.jsp?contid=2524368&from=yidian
— 完 —
「人工智能」、「智能汽车」微信社群邀你加入!
欢迎关注人工智能、智能汽车的小伙伴们加入我们,与AI从业者交流、切磋,不错过最新行业发展&技术进展。
ps.加好友请务必备注您的姓名-公司-职位哦~
点这里👇关注我,记得标星哦~
一键三连「分享」、「点赞」和「在看」
科技前沿进展日日相见~