编辑:袁榭 好困
【新智元导读】最近,上海交通大学研究团队仅用单个未受精卵母细胞,就培育出了实验小鼠的后代,而且还能活到成年再生子。
2022年3月7日,上海交通大学医学院附属仁济医院生殖医学中心魏延昌博士及研究团队在《美国国家科学院院刊》(PNAS)上发表了题为《自单个未受精哺乳动物卵子生出的存活后代》(Viable offspring derived from single unfertilized mammalian oocytes)的研究论文。
论文链接:
https://doi.org/10.1073/pnas.2115248119
利用基因编辑技术,研究团队让没有受精的雌性小鼠母体产下了健康且有正常生殖能力的后代,首次实现哺乳动物单个未受精卵后代的存活,成功完成了孤雌繁殖。
生物学上将卵细胞不经过受精发育成正常个体的过程,称作孤雌生殖(parthenogenesis)或雌核生殖(gynogenesis)。
不少爬行类、两栖类雌性动物可以在不交配的前提下依靠自己就能生育下后代。作为有性生殖的补充,孤雌生殖能在缺乏雄性的情况下,维持个体的繁衍与种群的更新。
孤雌生殖的方式,常见于植物以及部分无脊椎动物,比如蜜蜂和蚂蚁,蜂后和蚁后未受精的卵子可以发育成雄蜂或雄蚁。
即使是在脊椎动物中,爬行动物、鱼类和两栖动物都存在此类生殖方式,然而唯独哺乳动物没有。
1980年代,德国与英国的研究者通过小鼠试验证明,自然生殖中只有同时具备父系与母系染色体的哺乳动物胚胎才能存活。
这一现象的原因是「印记基因」/「基因组印记」(genomic imprinting)。这是哺乳动物的遗传物质中的独有现象:附着在DNA上的「甲基化」化学标签,会关闭特定基因因子的表达。
因此很多基因位点尽管具有父母双方来源的等位基因,序列无异,但是后代只转录或表达其中一方的遗传信息,另一个不表达或表达甚微。
所以哺乳动物胚胎只有同时携带父母双方的染色体才能实现互补,进而健康发育。单靠父源/母源一方提供的遗传物质,因为一些关键基因无法正确表达,哺乳动物胚胎常会出现严重的致死性基因缺陷。
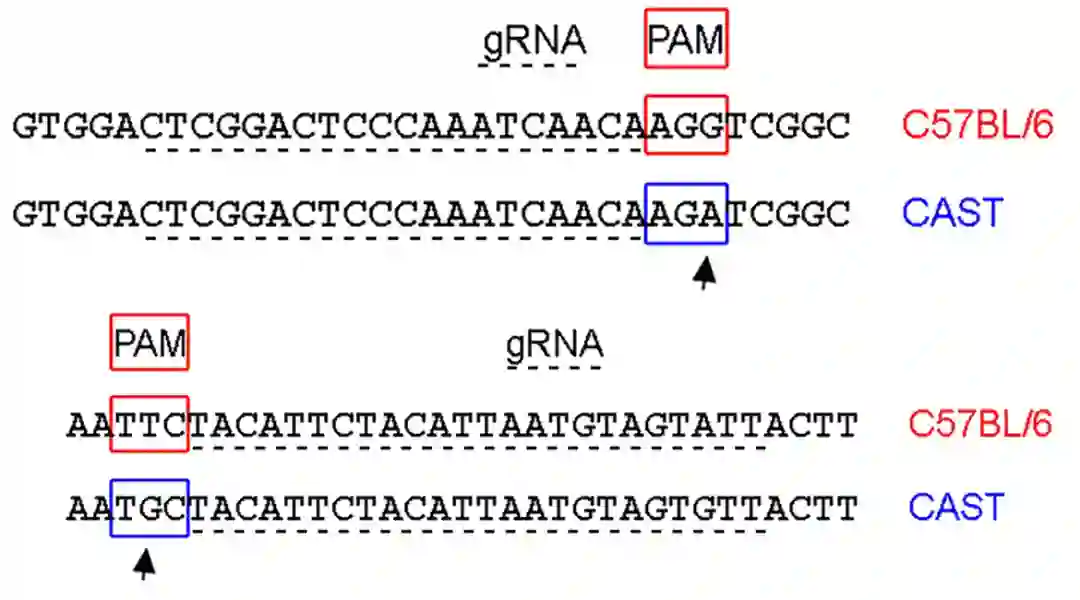
此次研究中,研究者们先从雌性小鼠体内取出未受精的卵母细胞,用CRISPR「基因剪刀」技术进行基因编辑。
通过对小鼠卵母细胞的七个关键基因组印记控制区域进行DNA甲基化重写,模仿雄性和雌性生殖细胞在正常受精过程中贡献的基因组印记,最终实现了只需要单个小鼠的卵母细胞就能产生后代。
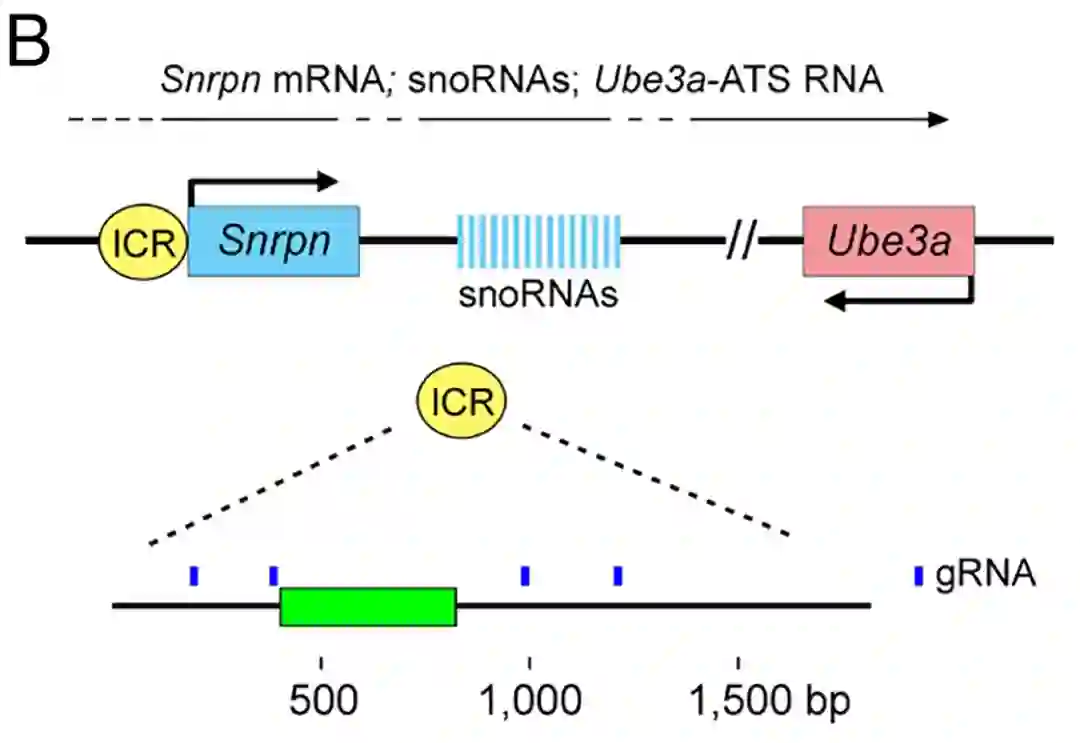
首先,研究团队在卵母细胞中发现了7个重要的印记控制区域(2个来自父系:H19和Gtl2;5个来自母系:lgf2r,Snrpn,Kcnq1ot1,Nespas,Peg10)。
然后,研究团队使用CRISPR-dCas9通过Dnmt3a甲基化酶增加两个父系基因组印记控制区域H19和Gtl2的甲基化,将其关闭。
同时使用CRISPR-dCpf1通过Tet1去甲基化酶实现母系基因组印记控制区域Igf2r、Snrpn、Kcnq1ot1、Nespas和Peg10的去甲基化,将其打开。
如此,单一来源的未受精卵细胞,可以分别模拟正常受精卵细胞中来自父亲和母亲的基因组印记。模拟正常受精状态的卵细胞即成为孤雌胚胎。
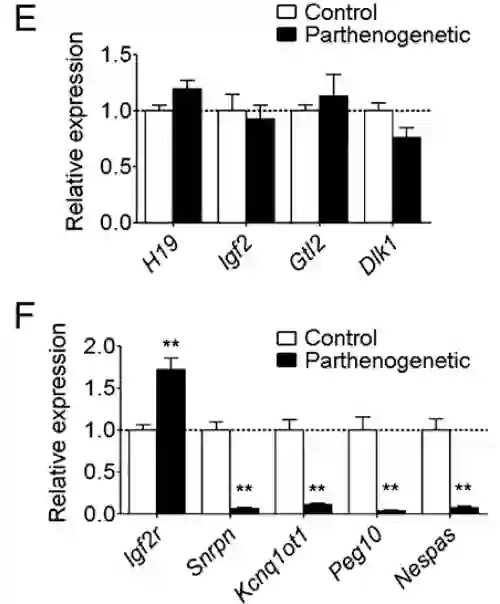
卵母细胞中的父系基因组印记和母系基因组印记的修饰后表达与对照组的对比
实验中,研究学者总共构建了389个经过修饰的孤雌胚胎,体外胚胎培养的过程中,仅有49.4%的发育成囊胚。
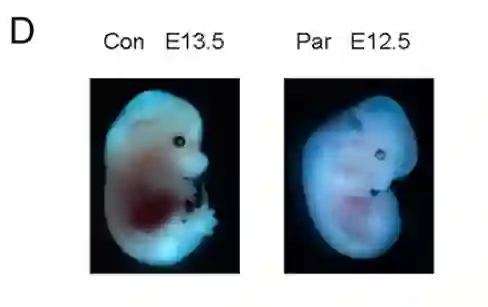
这192个经过编辑的囊胚在体外发育到早期胚胎阶段后,研究人员将这些单性生殖胚胎植入14个代孕雌性小鼠子宫,让它们继续在体内发育。这培育并移植的192例胚胎中,最终有3只小鼠足月诞生。
最终,3只小鼠中,有两只因体重过轻(0.783g和0.832g),出现生长迟缓,存活不足一天。
唯一存活下的一只小鼠,体重达到1.101g,与自然野生型小鼠体重接近(1.147±0.042g),并顺利活到成年,而且还在成年后通过正常生殖方式产下没有遗传障碍的后代。
未经编辑的对照组小鼠胚胎与经过编辑的孤雌繁殖小鼠胚胎的对比
研究人员通过测序验证,幸存的这只小鼠所有经过编辑的基因组印记控制区域都表现出了正确的甲基化模式。
而几乎所有构造后胚胎都是早夭或未能存活下来的原因,在于七个关键基因组印记控制区域中未能全部编辑成功,或是印记丢失。
这是否意味着未来人类繁衍不再需要男人了吗?当然不是。
即使不考虑巨大的伦理冲击,从这项实验来看,孤雌生殖的生殖效率极低。编辑脱靶是常态,而且是否有其他基因组印记区域对两性生殖过程有关键影响现在仍不清晰。
其实这几年来,中国的生物科学界在单性生殖领域上屡屡有重大突破。
2015年12月,中科院动物研究所胡宝洋研究员、周琪院士、李伟研究员在Nature的子刊《Cell Research》上发表了题为「Birth of fertile bimaternal offspring following intracytoplasmic injection of parthenogenetic haploid embryonic stem cells」的研究论文。
论文链接:
https://doi.org/10.1038/cr.2015.151
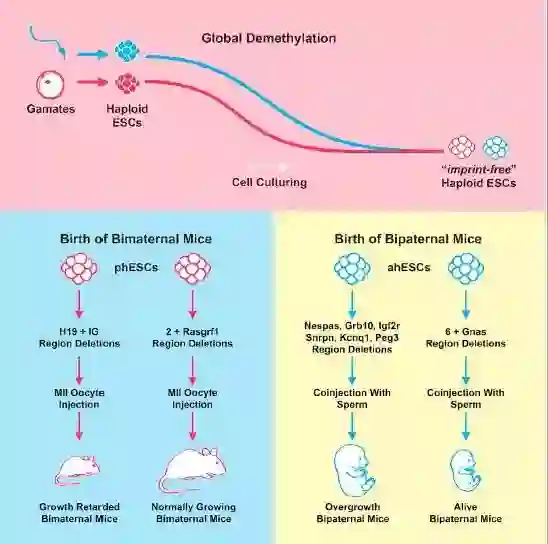
该研究通过对印记基因的修饰,成功得到了用两个雌性小鼠卵母细胞培育、具有两个母系基因组、活的孤雌繁殖小鼠,首次实现了哺乳动物的「女女生子」式孤雌生殖。
2016年3月,中国科学院动物研究所周琪院士、赵小阳研究员、南京医科大学沙家豪教授在《Cell Stem Cell》杂志发表了题为「Complete Meiosis from Embryonic Stem Cell-Derived Germ Cells In Vitro」的研究论文。
论文链接:
https://doi.org/10.1016/j.stem.2016.01.017
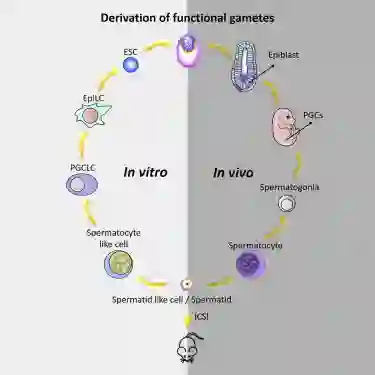
研究团队首先诱导小鼠胚胎干细胞产生了功能性精子样细胞(sperm-like cells),然后将这种精子样细胞注入小鼠卵细胞中,成功产生了能生育的小鼠后代。
这是人类首次在实验室中创造出有功能的「人造精子」。
2018年10月,中科院动物研究所胡宝洋研究员、周琪院士、李伟研究员在《Cell Stem Cell》杂志上发表论文。
宣布结合单倍体干细胞技术和基因编辑技术,首次获得从两个父本小鼠精子培育具有两个父系基因组的孤雄小鼠,首次实现了哺乳动物的「男男生子」式孤雄生殖。
参考资料:
https://www.pnas.org/doi/full/10.1073/pnas.2115248119
![]()
![]()