体外和硅毒性实验
IO时代,如何应对新药研发的挑战?
经典的药物研发模式逐渐褪去,目前我们已经进入药物研发的“无缝”时代,药物的第一次人体试验通常纳入大样本扩增队列,以早期探索药物疗效并寻求快速获批。不同制药企业之间的激烈竞争以及免疫联合治疗的狂热研发模式,迫使我们去思考,当下的药物研发模式存在哪些问题?近期,【Annals of Oncology】发布的一篇综述,讨论免疫治疗药物研发组的重要问题和注意事项。
背景
过去几年,免疫治疗I期研究经历了空前的变革,驱动这一变革的原因是,我们期望患者能够在药物研发早期即有机会接受到这一有前景的治疗,同时,各大制药企业希望尽快获批也起了推动作用。此外,药企和监管部门的精诚合作,很多药物能够基于I期研究数据即获得批准,促使免疫治疗研究数量与日俱增。传统的药物研发模式已经褪去,早期药物研发目前正经历着快速的I期剂量递增伴随大样本量的扩展队列。以帕博利珠单抗(Pembrolizumab)为例,2011年开始I期研究,2014年即获得FDA批准用于转移性黑色素瘤,相比于传统的药物研发到上市的10年历程,从研发到上市3年的时间创下了历史记录,也为后续IO领域的早期药物研发树立了榜样。
仅2017年,FDA就获批了10个免疫治疗适应症,截至2018年4月,ClinicalTrials官网上注册的肿瘤免疫治疗研究达1431个,且仍在不断增长。不同制药企业之间的激烈竞争以及免疫联合治疗的狂热研发模式,迫使我们去思考,当下的药物研发模式存在哪些问题?本文主要讨论了免疫检查点抑制剂研发中的重要问题和注意事项,特别强度临床前毒性评估的局限性以及I期研究中药物剂量确定的相关问题,并针对这些问题给予相应的建议,以期最大程度提高疗效,减少毒性。
临床前毒性评估
为了降低第一次人体试验的毒性,进行临床前的免疫药理学和免疫毒性实验不可或缺。临床前毒性实验可以帮助我们发现那些有毒性风险高的免疫检查点抑制剂,从而寻找疗效和毒性能够取得最佳平衡的药物。
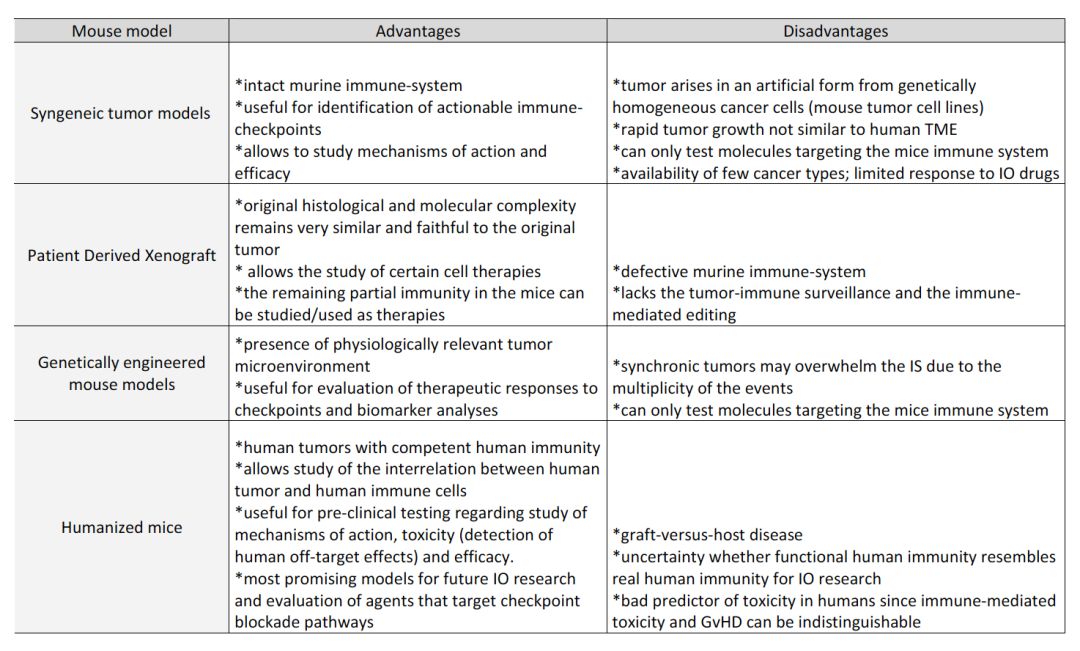
理想的临床前模型可以评估毒性、安全性和初步的抗肿瘤活性,然而目前在IO研究中,并没有最佳的模型可以模拟体内环境。人体和鼠的免疫系统存在很大的差距,在鼠模型上缺乏人体的免疫治疗的靶点,是目前鼠类模型的最大障碍。本文例举了一些IO临床前研究的主要模型,各个模型的优缺点总结见下表1.
表1. IO临床前研究常用的4类鼠模型优缺点对比
毒理学实验
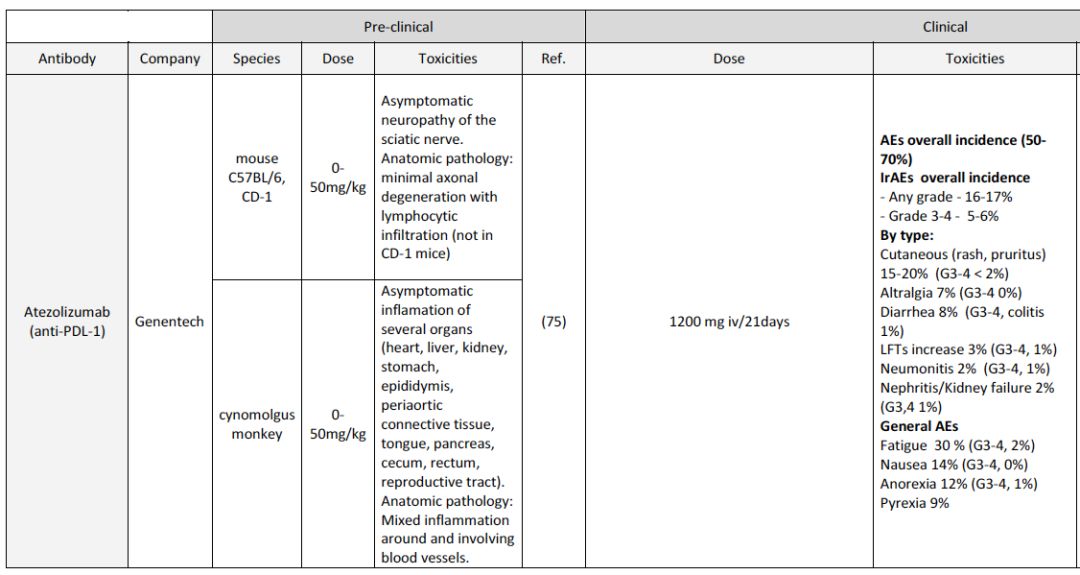
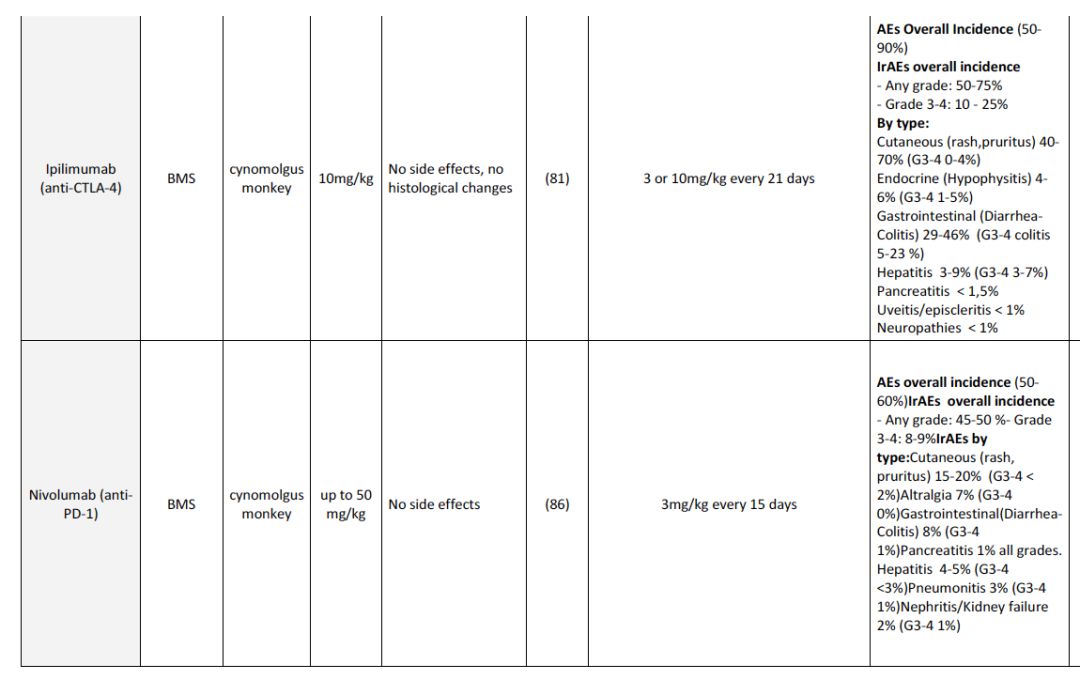
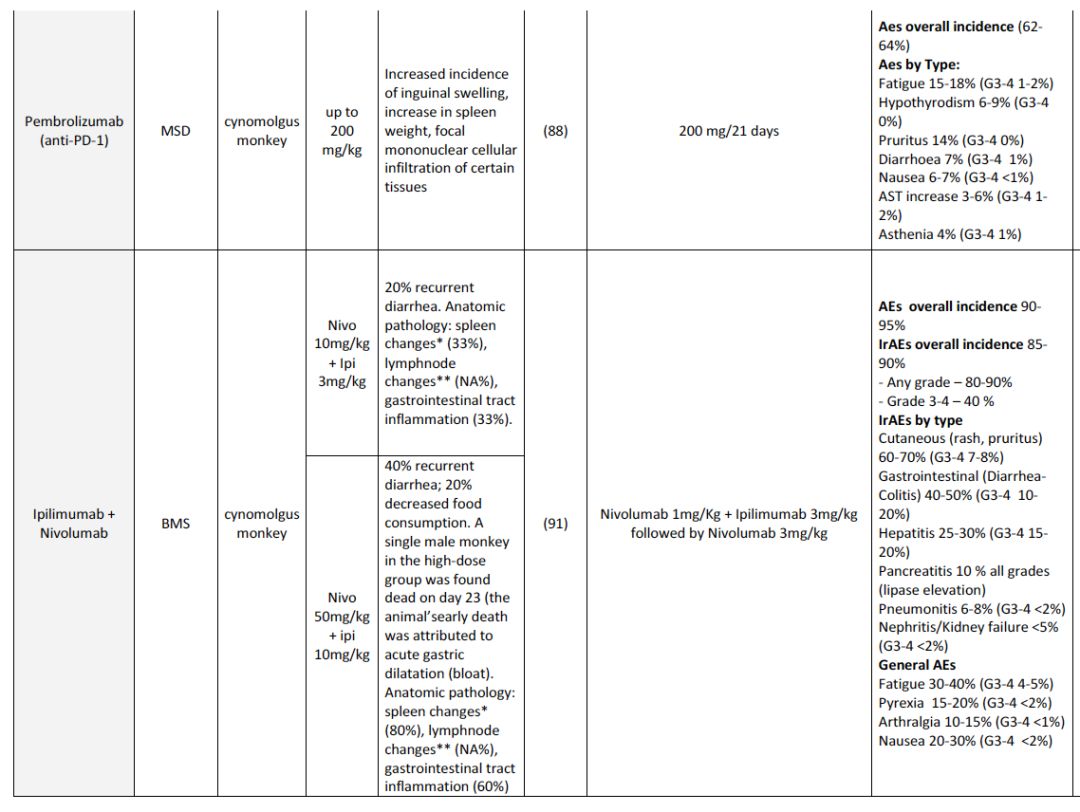
为了进行I期临床研究,需要在合适的动物体内进行临床前毒理学研究。食蟹猴和人体内的靶点相似,在毒理学研究最常用。尽管进行了严谨的临床前研究,但在真正进行人体试验时,仍然面临着很多不确定性,因此,第一次人体试验需要格外小心。如对CD28刺激单抗TGN1412的研究,在临床前安全性测试时,CD4+记忆T细胞不表达CD28,因此低估了其可能会引发人体的细胞因子风暴,这一事件提示我们在动物毒性实验的物种选择上,要格外小心。事实上,目前免疫检查点抑制剂在人体中的大多数毒性反应,在进行非人灵长类动物实验时均没有报道,下表2总结了目前进入临床的免疫检查点抑制剂,临床前实验和临床研究中的毒性对比。
表2. 不同免疫检查点抑制剂临床前毒性和观察到的人体毒性
综上可知,目前对于免疫药物的研发并没有理想的模型,体外和硅毒性实验仍有待进一步优化,可期精准预测毒性。目前,最常用的IO研究模型为同系小鼠模型(SMM),但是为了尽可能全面的疗效药物的活性和毒性,可以同时在多个模型中研究,这就可以克服各个模型的缺陷。其中,人源化的小鼠模型(HMM)能够更好的反映人体肿瘤和免疫系统之间的交互作用,因此,可能是研究抗肿瘤活性最佳的模型。在毒性实验中,虽然人体和小鼠的免疫系统存在差异,但SMM在众多模型中,可以更好的反映宿主细胞和竞争性的免疫系统直接的交互作用。虽然在每个药物研发过程中使用不同的模型耗时耗力,但有利于总体优化临床前IO研究。
剂量确定上的挑战
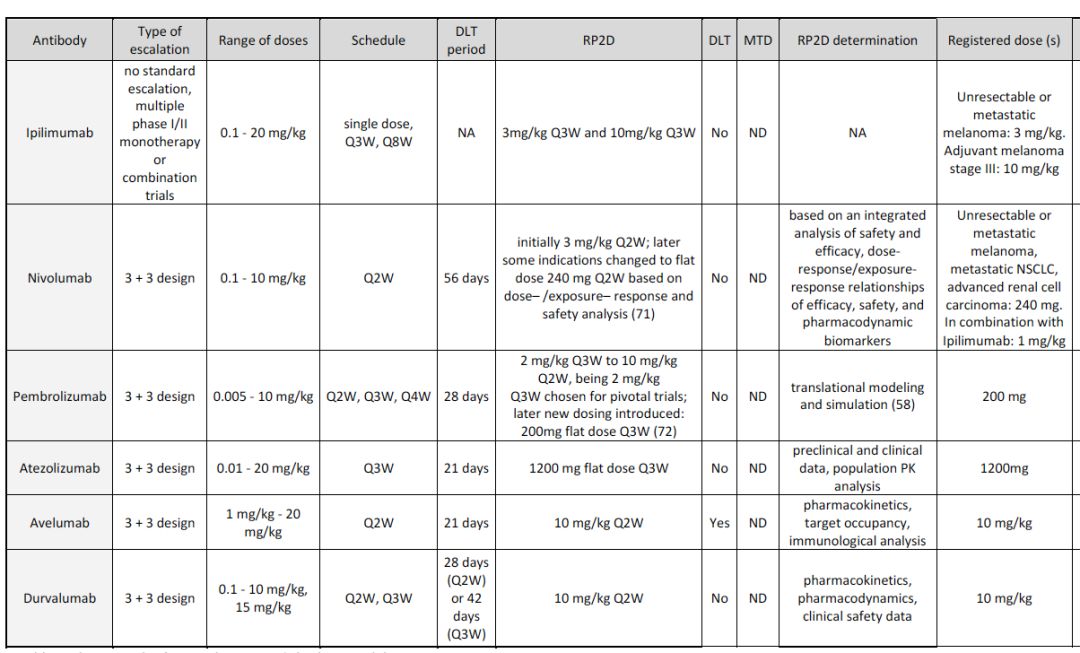
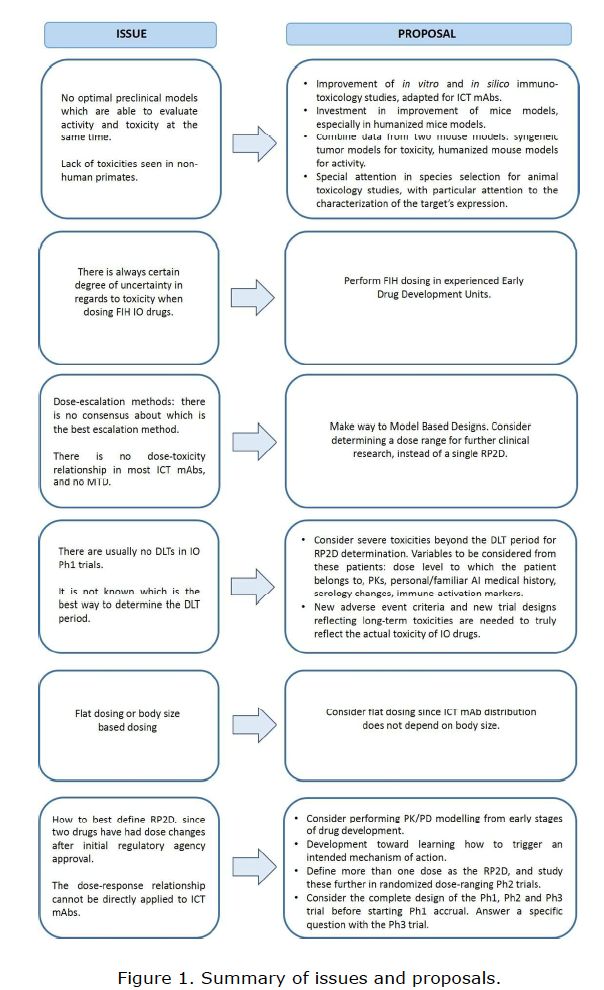
传统的药物研发模式为剂量越高,疗效越好,毒性也越大。然而,这一规律可能适用于化疗,但对于免疫检查点抑制剂而言,似乎并不适用,目前获批但6个免疫检查点抑制剂中,在I期研究中均未观察到剂量限制性毒性(DLTs),总结见下表3。此外,在上述研究中也均未达到最大耐受剂量(MTD),推荐的II期研究剂量(RP2D)是基于不同参数的考量,如临床疗效瓶颈,药代动力学数据或药代动力学模型。不同药物确定RP2D的方法各异,且纳武利尤单抗(Nivolumab)和帕博利珠单抗后续更改了剂量方案,这就加大了IO I期研究设计的难度。在设计I期研究中可能面临的主要陷阱及改进建议总结见下图1.
表3. 目前获批的免疫检查点抑制剂的I期研究总结
图1. IO I期研究设计时面临的主要陷阱及改进建议
剂量爬坡方法
第一次人体I期研究的起始剂量通常基于前面提及的毒性实验和后续的人体等效剂量来确定。在IO药物研发中,目前并没有最佳的剂量爬坡方法,基于规则的设计(rule-based designs),如“3+3”设计是目前最常用的。此外,基于模型的设计(Model-based designs,MBD)也可用于剂量爬坡研究,MBD通过纳入所有接受治疗患者的毒性数据,采用统计模型来预估增加剂量时出现DLTs的概率,并绘制精准的剂量毒性曲线,在试验结束时计算RP2D及其可信区间。MBD的优势是更为灵活,在预估MTD时准确性更高,且需要的样本量更小。近期发布的一项综述汇总了2008-2014年期间发表的临床研究,显示93%的试验采用基于规则的设计进行剂量爬坡,仅5%的研究采用MBD。这一模式目前正在转变,从我们中心的研究经验来看,大型的I期临床试验中心,IO药物研发中MBD的使用越来越多频繁。在我们中心,2017年IO相关的I期研究中,65%使用3+3设计,35%使用MBD。这一数据提示,虽然新的设计模式推行速度较慢,但在IO药物研发中将会占有一席之地。
DLT的定义和DLT周期
从表3可以看出,不同的免疫检查点抑制剂在I期研究中,DLT周期差异较大,从最短的21天到最长的56天。通常,DLT周期为一个治疗周期,但免疫治疗但DLT周期目前尚未明确,因为免疫相关不良事件的发生可能有延迟。在这种情况下,就会出现新的问题——超过DLT周期的严重毒性如何影响剂量爬坡决定。可能的解决方案是,在最终确定RP2D时,考虑这些延迟的毒性,即在确定RP2D时,单独考虑超过既定DLT周期的严重毒性。可以参考的因素包括个人和家族自身免疫疾病史,基线和治疗后血清学免疫活化标志物和患者的药代动力学。此外,为了真正反映免疫治疗的实际毒性,需要建立新的不良事件评估标准以及新的试验设计方案,可以反映这些长期毒性。目前,在药物研发中确定预测毒性的标志物显得愈发重要,为了发现那些可能出现毒性的高风险人群,需要进行基线的标志物检测,目前在适应性细胞治疗的研究中,以及开始采用这一测量。
如何确定RP2D
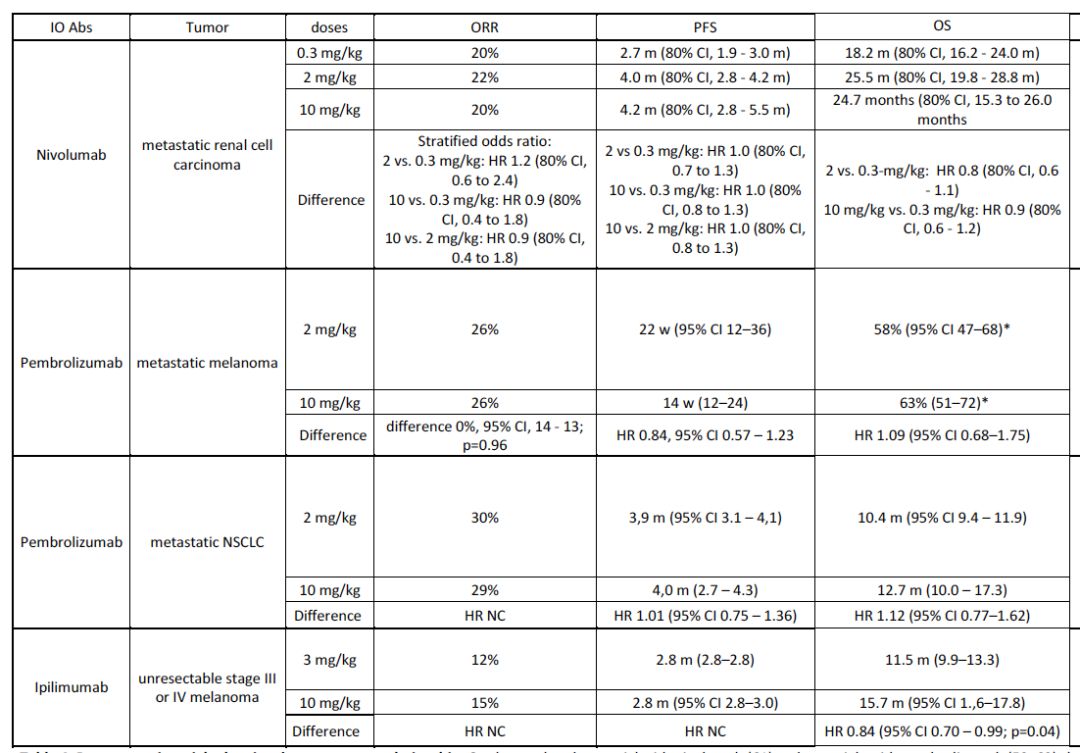
经典的药物研发会构建一个剂量疗效曲线,MTD作为确定RP2D的最重要参数。然而,这一线性模型并不直接适用于免疫治疗,从目前发表的免疫检查点抑制剂的临床研究数据来看,如下表4,不同于伊匹木单抗(高的剂量与更长的OS相关),纳武利尤单抗和帕博利珠单抗并没有观察到明显的剂量疗效关系。此外,不同免疫检查点抑制剂在确定RP2D时方法各异,驱使我们不得不质疑目前的剂量确定方法。如表3显示,6个获批的药物是基于PK,PD和安全性数据确定RP2D。
其中,帕博利珠单抗的剂量确定方法值得一提。从IB期多队列研究中观察到初步的有前景的疗效后,制药企业期望快速研发获批上市,因此剂量波动范围非常小。为了确定帕博利珠单抗的剂量,模拟了PK/PD模型,应用数学和统计模型描述疾病进展,PK和PD,最终预测药物暴露和疗效的关系,从而使得药物研发项目进行迅速。鉴于多数免疫检查点抑制剂并没有线性剂量疗效关系,因此可以考虑采用数学模型来确定RP2D。
为了进行后续的剂量范围研究,可以考虑在I期研究中推荐不仅1个RP2D,仅确定不同的RP2Ds(设立最高和最低上限,即MTD和最小有效剂量),然后在II期研究中进行随机的剂量范围的研究,以确定III期研究最佳的剂量。此外,在IO研究中,I期研究不仅仅为了确定RP2D,同时也为我们提供机会去探寻患者疗效和毒性的机制。
表4. 描述剂量疗效关系的代表性研究
尽管目前进行了多项研究探寻免疫治疗的疗效预测标志物,但目前仍没有一个确定的标志物。鉴于免疫系统和肿瘤之间复杂的关系和不同患者之间的异质性,需要探寻联合的生物标志物,单一的标志物可能很难反映复杂的肿瘤微环境。目前,在很多IO的研究中,都采集了患者基线和治疗过程中的血浆和组织标本,以进行相关的分析。
剂量确定(固定剂量 vs 基于体重定量)
单抗类药物的剂量通常是基于患者的体表面积,以校正不同患者之间药物分布和清除的差异。然而免疫球蛋白主要分布于血浆和细胞外液,不受体重的影响,基于体表面积的剂量调整就值得质疑。此外,固定剂量有特定的优势,如减少浪费,使用方便,减少给药剂量上的计算失误。最初,纳武利尤单抗和帕博利珠单抗都是根据体重给药,但后续都改为固定剂量。主要是基于人群PK模型的分析,两种给药模式的PK,安全性和疗效相当。
总结
当下,免疫治疗引领了肿瘤治疗的重大变革,也第一次让我们看到晚期肿瘤有治愈的可能。IO的研发非常迅速,投入了大量的资金和资源,正因如此,我们更应该审视当下的研发策略,寻求最合理的研发模式,最终给患者带来持续、最大的获益。
Early Drug Development in the era of Immuno-Oncology: are we ready to face the challenges?
Annals of Oncology, mdy225, https://doi.org/10.1093/annonc/mdy225
Published 26 June 2018
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情