AI审批即将全力加速!药监局主导的人工智能医疗器械创新推进会干货梳理
距离正式向AI企业发布《深度学习辅助决策医疗器械软件审批要点》仅半月,药监局再次展开了AI器械审批相关的大动作。
7月17日,由国家药品监督管理局医疗器械技术审评中心、中央网络办国家计算机网络与信息安全管理中心、中国信息通信研究院、国家卫生健康委国际交流与交流中心、中国生物技术发展中心、中国生物医药工程学会、中国人民解放军总医院、中国医学科学院北京协和医院、四川大学华西医院、上海申康医院发展中心、清华大学、浙江大学、四川大学、华南理工大学联合主办的人工智能医疗器械创新推进会在京展开。国家药品监督管理局局长焦红、国家药品监督管理局副局长徐景和、国家药品监督管理局医疗器械技术审评中心主任孙磊、国家局医疗器械技术审评中心副主任邓刚、国家工业和信息化部党组成员、总工程师张峰均出席了本次会议。
大会之上,人工智能医疗器械创新合作平台在此成立。该平台以构建开放协同共享的人工智能医疗器械创新体系,形成服务于科学监管、科技创新、产品转化的人工智能医疗器械创新合作平台为目标愿景,将全力推动医学人工智能产品审批。
在此,动脉网记者对会议的部分内容进行了梳理,尝试帮助医疗AI的从业人员理清药监局审批的思路与要点,其内容主要包括以下三个方面:
一、人工智能医疗器械创新合作平台组织架构;
二、数据安全问题及相关建议;
三、数据库建立路径、数据库种类确立及数据库监控维护。
产学研多方参与平台搭建
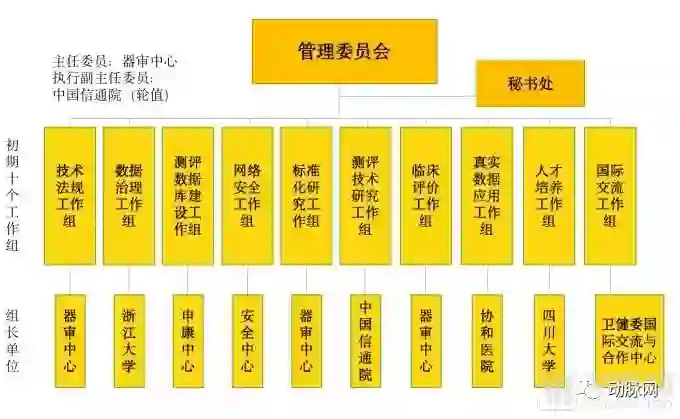
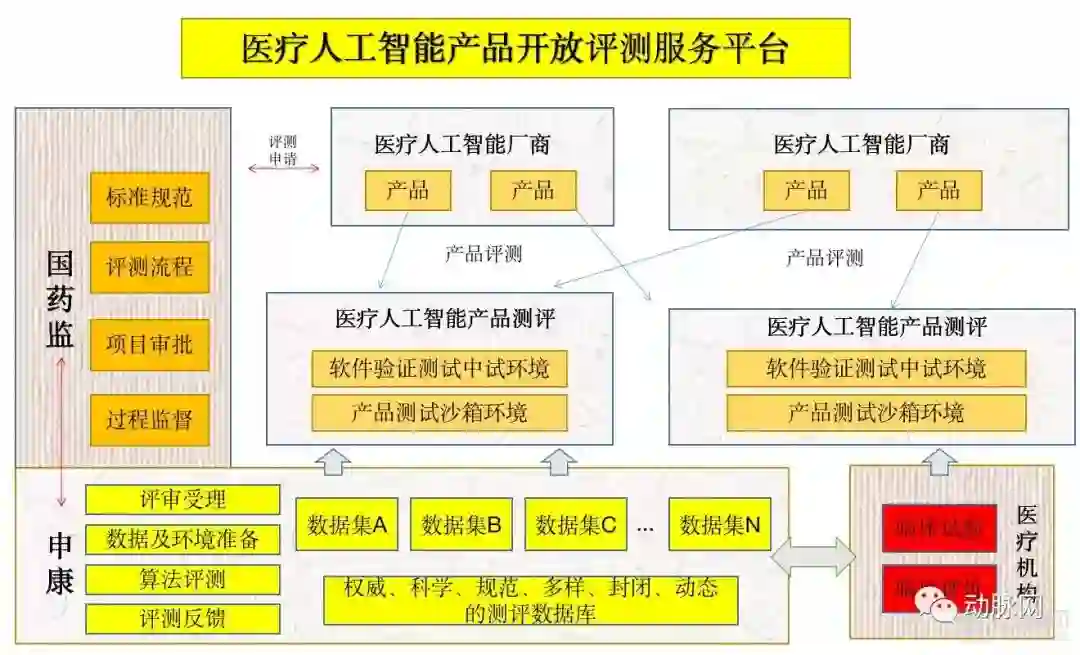
人工智能医疗器械创新合作平台由中央国家机关事业单位、学会、医疗机构与高校共同参与构成。管理委员会统一管辖下属10个初期工作组,各个工作组又由不同的机构参与管理。
平台架构
从上图可以看到,器审中心兼任了医疗AI产品审批过程中最为重要的技术法规、标准化研究、临床评价三个工作组。测评数据库建设这一重要工作组由上海申康医院发展中心主要负责。而本次会议中重点提及的安全问题由中央网络办国家计算机网络与信息安全管理中心负责。
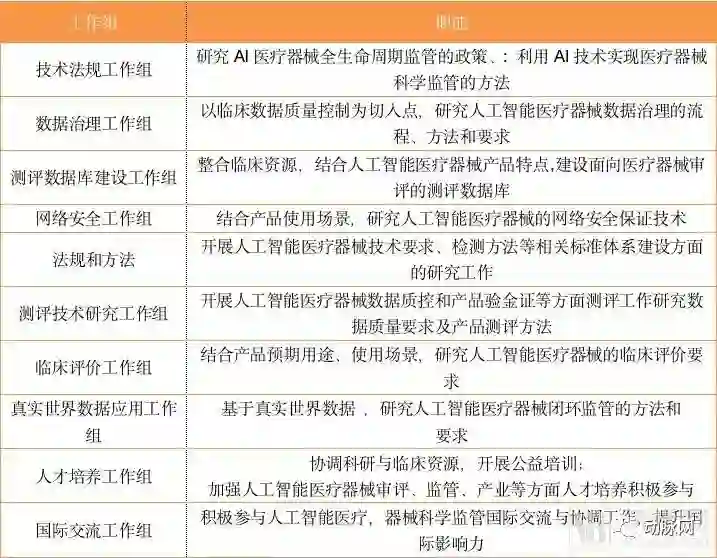
各工作组职能分布
从10个工作组的职能分布上看,本次会议可谓深思熟虑。创新平台不仅将审批常见的临床、数据标准化、网络安全等问题纳入考核之中,还将人工智能人才培养、人工智能国际监督交流等非政府机构职能纳入了并行工作组。
此外,与数据库相关的工作组高达三个,分别对检验数据库、真实世界数据、数据检验进行独立研究,足以看出器审中心对于数据这一AI核心要素的重视,这或许意味着数据将成为制约人工智能企业发展的关键。
数据安全成为AI关注重点
网信办安全中心邹潇湘在大会上进行了数据安全相关的主题演讲,她表示:“在器审中心的指导下,根据CMDE《医疗器械网络安全注册技术审查指导原则》、FFDA《医疗设备网络安全管理上市前指导原则》等文件,依托网信办安全中心技术支持,我国已完成三项重要的医疗器械网络安全测评工作。”这些工作包括:
1. 制定20个网络安全标准测试用例;
2. 对8家国内外主流厂商的15款产品开展安全测评;
3. 出具15份安全测评报告。
在医疗器械网络安全的测评工作中,网信办安全中心发现:医疗器械存在较多安全隐患且无法得到及时修复;厂商在设计时没有考虑相应的安全性问题;而安全性提高需要得到医院等医疗机构的配合。
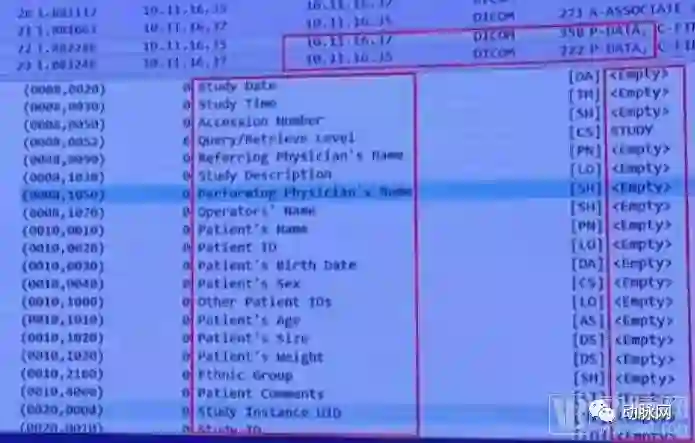
前期测评中的大部分医疗器械制造商均未考虑健康数据传输过程中的保密性问题,在测试中,网信办安全中心捕获大量的明文健康数据。
捕获状况截图
对于这一状况,邹潇湘表示:“医疗机构在对健康数据进行归档、备份等数据传输操作时,尤其是通过公共互联网传输敏感数据时,应该对敏感数据进行加密处理,否则可能造成医疗健康数据信息泄露。”
智慧医疗云是另一个安全问题的重灾区,这一平台在将封闭孤立的医疗机构推向开放互联的同时,也承担着更为严峻的安全考验。
统计显示,仅在2018年,全球便发生了十余起10万以上数据泄漏事件:俄克拉荷马州立大学健康中心遭黑客入侵,近28万名患者医疗账单信息泄洞;LfeBridge Health公司遭恶意软件攻击,约50万名患者一年多的私人信息泄源;新加坡政府健康数据库遭黑客攻击,150万患者数据泄漏;UnityPoint Health遭钓鱼攻击140万患者记录泄漏;美国实古斯塔大学医疗中心遭到网络钓鱼攻击, 41.7万份记录泄露……
诸多事件的发生足以显示网络安全的重要性,医联体各医院网络安全防护能力有高有底,只要有一个医疗机构被突破,整个体系存在数据泄漏的可能。因此,邹潇湘将医联体的网络安全比作木桶,“一点突破,满盘皆输”。
目前全国共有657家智慧医疗云平台,其中北京的云平台数量超过200家,广东、浙江约100家,上海近70家,山东近50家,这四个城市是信息化产业生根的主要城市。
网信办安全中心其中对79家进行抽检,结果显示,57家平台存在高危漏洞,13家平台存在中危漏洞,89%的医疗机构存在较为严重的安全风险。
黑客利用这些漏洞可以渗透攻击PACS、HIS、病例管理等系统,严重影响平台的正常运行;删改患者会诊信息,耽误患者治疗;远程控制患者治疗的试剂剂量,严重可造成患者死亡;窃取患者治疗信息、基因等数据,泄露公民隐私。
因此,对于网络安全中的诸多问题,邹潇湘提出了以下建议。
01
关于标准规范和检测认证
1、研究面向人工智能医疗器械的网络安全相关标准和可操作的测评规他及万法,研究相关标准规范,构建网络安全测试技术体系。
2. 对于医疗领域采用的重要系统与关键设备,应该实施例行的入网安全检测与认证,必要时进行全面的网络安全审看,以全面掌握其安全性状况。
3、通过安全检测与认证,建立统一的医疗行业网络安全成胁情报库和国家獺润信息共享平台CNVD。
02
关于安全检查和风险评估
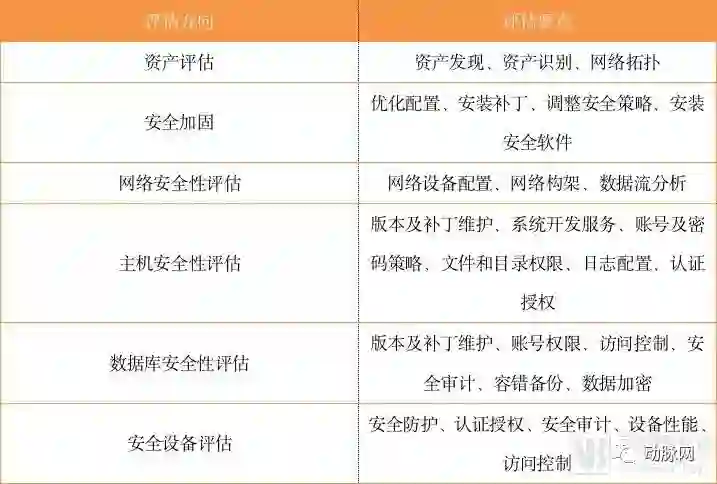
1、上线前的风险评估:对于有联网(外)或入网(内)需求的医疗器械,须具备必要的网络安全风险防控能力。建议由行业主管部门统一组织或授权,针对安全防护措施对其进行上线前的风险评估。
2、运行中的安全检查:对已联网(外)或入网(内)的医疗器械,建议由行业主管部门统一组织或授权,对其开展不定期的远程遇检或现场检查,以全面掌握国家医疗器械的整体安全性状况。
评估要素
03
关于态势感知和预警
1、加强网络安全主动发现能力建设:通过在网络空间开展联网设备、组件及系统的探测发现,有助于我们提前发现幕露在互联网上的医疗器械及其组件。
2、加强网络安全监测预警能力建设:通过在互联网关键节点对医疗通信流量的监测分析,有助于及时发现医疗器械网络空间当前状态,并对下一步的发展态势快速预测。
“‘有些重发展轻安全、重建设轻防护;有的认为关起门来搞更安全,不愿立足开放环境搞安全;有的认为网络安全是中央的事、专业部门的事,同自己无关’一这些看法都是不正确的。”邹潇湘总结到。
“要落实医疗器械网络防护责任,行业、企业作为运营者承担主体防护责任,主管部门履行好监管责任。针对“云、管、端”暴露的问题,从医疗器械及其配套软件、智慧云平台系统安全和应用安全的角度出发设计,建立医疗器械安全防护技术体系,全面提升健康数据保护能力和安全威胁防御能力。”
CT肺、脑MRI、冠脉CTA等8种测试样本数据库样本数据将成立,申康中心承担建设工作
未来人工智能测评数据库将由上海申康医院发展中心负责建设,上海申康医院发展中心医联中心主任何萍在会上表示:申康中心将整合临床资源,结合人工智能医疗器械产品特点,以建设面向医疗器械审评的测评数据库。演讲内容由以下几个要点组成。
01
数据库建立方向
数据库的建立是人工智能产品审批的先行之举,过去仅存在肺结节和眼底两类影像,而且未确定测试数据库的类型。本次会议上,何萍先从宏观层面上讲述了数据库的建立路径,主要包含以下三点。
1. 将申康医联大数据基础上,建立起可高效用于人工智能研究和研发的专用“人工智能+医学影像类系统的审评技术及专业数据库”的标准、规范管理条例以及伦理学标准。
2. 开展示范应用,以不断改进和提升“人工智能+医学影像类系统的审评技术及专业数据库”。
3. 在此基础上建成“人工智能+医学影像类系统的审评技术及专业数据库” ,为全国大规模应用推广建立基础。
02
建库模式
在确立数据库的建设方向之后,数据的选择则是更为困难的一个问题。在这一方面,何萍提出了测试数据选择的多项要求,并声明企业可简洁参与。
1. 来源真实世界、拥有数据所有权、动态增长、多中心多样化的医疗数据。具体包括:采集38家三甲医院的全量诊疗数据+合作单位医疗数据目录库(动态增长);天然满足多中心、多设备、多模态等要求(多中心);保证未来测试数据具有多样、真实、可靠的数据来源(多样性);医疗数据的标准、种类、体量能满足各类数据抽样方法的要求(超大样本)。
2. 严格的数据资产管控
建设医疗大数据管控平台,更好地管理大数据资产(标准规范);完善的数据治理制度、标准、流程和系统(安全可控)。
3. 企业参与模式
在建设主体单位拥有建设主导权的情况下,企业可间接参与。
03
建设目标
那么,申康中心将在短期之后进行怎样的具体工作呢?何萍将其总结为“一二三四八”五点。
一指1个门户网站,即国家人工智能医学软件测评服务门户;
二指2个平台,即医学软件测评数据中台、医学软件测评服务平台;
三指3个数据中心,即全样本大数据中心、标注数据中心、测评数据中心;
四指4级数据质量治理技术体系,即医疗数据规范性质控、数据采集校验质控、数据融合质控、数据开发利用;
八指8种以上测试样本数据库:即CT肺、CT肝、 CT骨折、脑MRI、心脏MRI、冠脉CTA、心电、眼科......
此外,上海申康医院发展中心还将建立多个医学软件临床评价试验基地,包括上海申康、301、 四川华西、北京协和等。
同时,申康中心还将建设人工智能产品具体测评平台,其工作运行方式由下图所示。
04
平台服务模式说明(数据管理)
构建数据库完成后,怎样使用数据库,并确保数据安全同样成为了本次演讲的重点,其内容可总结四点。
1. 构建“人工智能+医学影像类系统的审评技术及专业数据库”,统汇总各方数据目录,并提供搜索引擎及目录树,并将搜索的结果整合为最终结果反贵给用户,用户依据搜索结果与数据主体医院合作。门户运营方负责保证数据目录在各个主体之间、及对外反馈结果过程中的安全合规性。
2. 医院数据中心、区域数据中心:共同构建数据管控和应用平台,联合治理和管控好数据,并为各机构内部的临床研究、成果转化、人工智能应用需求提供服务。
3. 医院、区域等数据:数据不出机构,通过管控平台,仅提供数据目录给用户方进行索引。
4. 医院、区域等数据:提供结果分析数据给用户使用时,进行严格的数据监管,保障数据安全。
05
数据库监控
除去数据库建设、数据收集、规章制定外,申康中心还制定的严格的监控程序,这一点在过去未曾提及。
1. 资源计量统计报表:周期性对每个项目下的资源进行计量报表,并通过多种统计图表展现各个项目的资源使用量以及资源使用趋势,让管理员可以清晰地看到各个项目下资源的总量分析、趋势分析,为业务决策提供帮助;
2. 资源池容量分析:对数据中心以及对现网运营设备按负载率持续性、机型、负载指标统计出容量数据,及时发现低负载的空闲设备,提高资源的使用率,降低运营成本;
3. 周期报表:统计各类资源的用户使用量、每类资源的使用情况,如基础云平台、业务系统的CPU、内存、存储、IP的资源总量及占用量。周期性生成报表,并通过设置的邮件地址自动发送报表邮件。
在完成对申康中心的职能介绍后,何萍将申康中心的工作目标总结为以下四点。
1. 申康中心在国家药监局器审中心的带领下,联合好工作组和课题组,牢牢把握重要战略机遇期的科学判断,坚持推动高质量发展,加快推进医疗人工智能的建设发展。
2. 承担好人工智能医疗器械测评库数据方面的子课题负责人职能,建成基于人工智能的医疗测评数据库,对临床医疗数据进行编目、汇聚、整合,保障数据安全、推动医疗数据在人工智能医疗器械方面的利用;率先形成一套数据标准和管理规范。
3. 打通医疗人工智能研发应用所需的应用场景和数据,研究完善临床科研管理及创新体系,逐步形成未来智能医疗生态体系中价值贡献者的资源共建共享、业务协同、利益共享平台。
4. 激发医疗和科研机构创新活力,利用全球创新要素,探索从科学研究、到临床验证、再到技术转化的新模式,培育人工智能医疗与健康科技产业。
总结
大会同样提到了人工智能医疗器械审评指导原则体系构建。本次大会上的演讲主要是对6月28日国家药品监督管理局医疗器械技术审评中心发布的《深度学习辅助决策医疗器械软件审批要点》进行解读,其内容由适用范围、审批关注要点、软件更新、相关技术考量、注册申报资料说明五个方面组成。动脉网在《药监局发布医疗AI产品审批要点,人工智能企业是否准备就绪?》中已做梳理分析,这里不再赘述。
从整个会议内容来看,动脉网将其中的亮点提取为以下六点:
1. 体制的完善
在外部看来,过去的审批体制并不透明。相关各项职能集中于器审中心,但具体职能划分从外部难以洞察。此次创新合作平台的出现不仅将整个医疗AI审批的各项职能划分到了各个工作组,还将各个工作组分配到了不同机构。如今,整个流程已成体系,职能划分明确,这将极大推动AI产品审批进展。
2. 多方参与
创新合作平台的运作将不再由中央国家机关事业单位独立主导,学会、医疗机构以及高校纷纷加入其中。在当前阶段,医疗AI谈不上成熟,市场却需求强烈,所以产学研结合的模式既能一定程度上保障市场需求,又能在现有基础上继续深入研究。
3. 云平台安全问题
云平台安全问题一直饱受诟病,而此次网信办安全中心的调查则以数字的方式向各位展示了互联互通大环境下的真实状况。而需求孕育创新,为保障医联体的安全运行,国家将会加大在医院数据安全方面的投入,而这一痛点或许也将孕育一批新的紧跟市场的巨头。
4. 新的测试数据库建立计划
大会提出,CT肺、CT肝、 CT骨折、脑MRI、心脏MRI、冠脉CTA、心电、眼科等影像测试数据库建设将成为上海申康中心的目标,这八类产品囊括了市面上大部分人工智能产品。这项动作充分显示出了企业对政策的助推作用;同时,该计划也为医生使用这些产品打下了一针强心剂,药监局在一定程度上认可了这些产品未来;最后,数据库的建立意味着这几项产品将大概率先一步获得审批。
5. 明确的数据管理制度
在上海申康医院发展中心医联中心主任何萍的发言之中,我们能看到药监局严格规定了不同医疗机构、区域数据的流转规定及院方职能。这意味着过去部分院企打擦边球的手段将得到遏制。当然,更严格的监管意味着数据更难以获取,初创企业需要付出更多的成本,并以新的合作形式获取数据,已训练出成熟算法的公司或将因此壁垒高筑。
6. 风险评估指标制定
人工智能医疗器械审评指导原则体系强调了假阳性和假阴性的标准,在当前情况下,企业提供的数据多是来源不明的,准确性与敏感性都存在问题。该体系的制定或许会给予AI产品一个明确的质量判定指标。
从六点中可以看出,国药监局已在医疗AI产品审批推动方面下足了决心,但其中的临床评价事务仍值得注意。从平台体系可以看到,临床评价这一项工作依旧由器审中心负责,而当前的实际形式是各家企业仍难以通过临床实验评估。
真实数据应用组的工作或将有助于帮助企业通过临床试验,但这仍意味着企业需要对人工智能在真实世界的应用能力进行提升,要想AI落地于医院,这是AI企业永远绕不过的坎。所以,想要在医疗AI领域跑通,企业方还需继续求索。
感谢
数坤科技CEO马春娥提供了观点支持,数坤科技作为医疗人工智能头部企业也被邀参加了本次会议。马春娥认为,本次大会是国药监牵头,规格高,平台大,代表政府推动医疗人工智能产业发展的决心和实际行动。政企医研深度合作,会对行业规范化发展和规模化发展,起到积极的推动作用。
*封面图片来源:https://www.123rf.com.cn
文 | 赵泓维
微信 | qq850860074
添加时请注明:姓名-公司-职位
网站、公众号等转载请联系授权
寻求合伙人

点击“阅读原文”,每天都有新发现!