汤富酬/乔杰/赵小阳课题组Cell子刊新成果!建立人类精子发生过程高精度转录组图谱
图片来源:Pixabay
全世界约有10-15%的育龄夫妇存在不孕不育的问题,其中,男性因素约占50%左右。阐明人类精子发生过程中的基因表达调控机制是发育生物学的重大科学问题,对理解、诊断和治疗男性不育相关疾病至关重要。
8月30日,这一由中国团队完成的新研究在国际知名学术期刊《Cell Stem Cell》上在线发表,他们首次从单细胞水平系统阐明了人类精子发生过程中的基因表达调控网络和细胞命运转变路径,绘制了人类精子发生的高精度单细胞转录组图谱,解析了成年男性全部生殖细胞类型及其关键的分子标记,并初步探索了将单细胞转录组技术用于人类非梗阻性无精症的研究和诊断。
研究团队首先分离并获取了正常成年男性和梗阻性无精症患者的2,854个睾丸组织细胞,对其进行了高精度的单细胞转录组测序分析,并结合t-SNE、PCA和Monocle2等多种生物信息学分析方法对这些数据进行深度挖掘,在国际上首次完成了人类精子发生过程中的细胞命运转变和基因表达图谱的绘制。在此基础上,研究团队进一步对一例非梗阻性无精症患者的174个睾丸细胞进行研究,确定了该无精症患者睾丸中的各种细胞类型及其与正常人睾丸中对应的细胞类型相比发生的基因表达异常,为男性不育的临床诊断提供了新的思路。
该项研究主要的成果:
01
人类精子发生过程中的细胞命运转变和基因表达动态
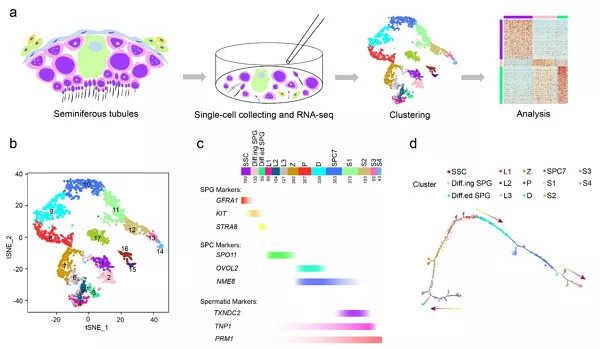
该研究选取临床捐献的成年男性睾丸组织为材料,通过随机挑选或流式分选两种策略获取睾丸组织的单细胞样品,随后进行高精度单细胞转录组测序,并借助计算生物学方法对单细胞转录组数据进行深度挖掘(图1a)。经过非监督聚类分析,发现在2,854个睾丸细胞中共存在17种不同的细胞类型,其中14种为各个分化阶段的睾丸生殖细胞,另外3种为睾丸微环境体细胞(图1b)。利用众多特异的标志基因对所有细胞类型进行身份鉴定,最终确定出3种精原细胞,包括精原干细胞(SSC)、分化中的精原细胞(Diff.ing SPG)、分化后的精原细胞(Diff.ed SPG);7种精母细胞,包括3种细线期精母细胞(L1~L3)、偶线期精母细胞(Z)、粗线期精母细胞(P)、双线期精母细胞(D)、分裂期初级精母细胞及次级精母细胞(SPC7);以及4种精子细胞(S1~S4)(图1c)。通过Monocle2对人类精子发生过程进行拟时间发育分析,发现由以上14种生殖细胞构成的发育路径与经典的生精上皮发育过程高度吻合(图1d)。至此,该研究首次借助高精度单细胞转录组测序技术完整地描绘了人类精子发生过程中细胞命运转变的精确过程和基因表达变化的动态图谱,为进一步深度解析人类精子的发生过程奠定了重要的研究基础。
图1. 人类精子发生的单细胞转录组图谱:(a)研究流程示意图;(b)17类睾丸细胞转录组的t-SNE分析图;(c)人类生精过程中标志基因的动态表达变化图;(d)人类睾丸生殖细胞的拟时间发育图
02
人类精原细胞的自我更新、分化及参与的信号通路
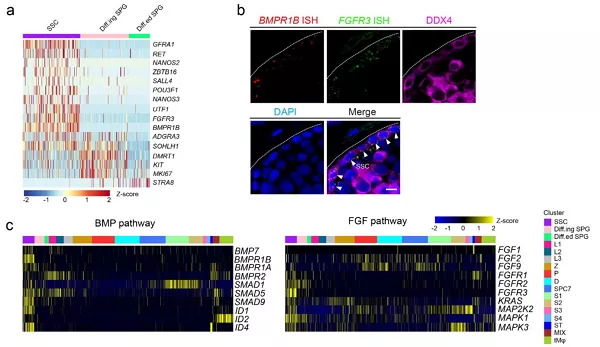
基于t-SNE分析,该研究发现了3种人类精原细胞类型,通过分析细胞类型特异的标志基因在3种精原细胞类型中的表达特征,发现精原干细胞高度富集了与自我更新调控相关的GFRA1、RET以及与干性维持相关的SALL4、UTF1等关键基因;而进入到下一个发育阶段(分化中的精原细胞),DMRT1、KIT等与精原分化相关的基因开始富集;最终在分化后的精原细胞中,减数分裂启动的标志分子STRA8开始高表达,标志着人类精原细胞正式启动减数分裂(图2a)。除了经典的RET信号通路,该研究发现并且验证了BMPR1B与FGFR3为人类精原干细胞特异性表达的标志分子,也首次在精原干细胞中发现BMP与FGF信号通路从配体、受体到效应分子均呈现高度富集的特点(图2b,2c),这一结果表明,BMP和FGF信号通路很可能在人类精原干细胞的自我更新过程中发挥了关键作用。
图2. 精原细胞的基因表达调控:(a)精原细胞阶段特异标志基因的表达热图;(b)睾丸组织BMPR1B、FGFR3的RNA原位杂交与DDX4的免疫荧光染色定位;(c)BMP、FGF信号通路关键基因的表达热图
03
人类精母细胞的基因表达特征
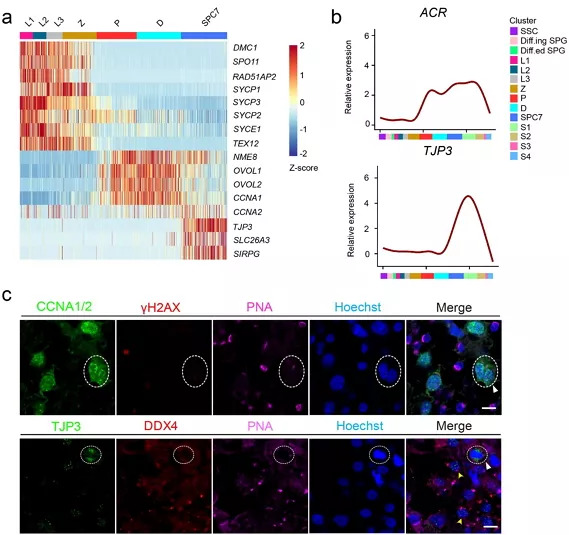
精原细胞进入减数分裂并发育为各级精母细胞,在细线期与偶线期,同源重组相关基因DMC1、SPO11与联会复合体组分SYCP1、SYCP3、SYCE1等高度富集(图3a),表明该阶段正在高度有序地发生同源重组与同源染色体联会等重要的生物学事件,以确保减数分裂的正确发生。随着粗线期(P)同源染色体配对与联会的完成,联会复合体逐渐在双线期(D)开始解体,随后初级精母细胞进入分裂期,进而一分为二产生2个次级精母细胞(SPC7)。由于分裂期初级精母细胞与次级精母细胞发育进程非常短暂,其基因表达特征鲜有报道。在该研究中,通过对各级精母细胞的基因表达特征进行精细分析,并结合CCNA1/2、顶体素酶原(ACR)、γH2AX、DDX4等的表达特征(图3a,3b),首次实现了对人类分裂期初级精母细胞与次级精母细胞的身份确认,并确定了其整体水平上的基因表达特征。
图3. 精母细胞的基因表达调控:(a)精母细胞阶段特异标志基因的表达热图;(b)ACR、TJP3的表达图;(c)CCNA1/2、PNA、γH2AX和DDX4在SPC7中的表达特征
04
人类精子细胞的发育及其调控机制
1个四倍体的初级精母细胞会产生2个二倍体的次级精母细胞,并最终产生4个单倍体的精子细胞。随后,精子细胞需要经过鱼精蛋白转换、细胞质脱落、鞭毛生成等一系列的重要生物学变化,最终成为可游动的成熟精子。在整体转录水平上,精子细胞从第一个阶段(S1)到第四个阶段(S4)呈现转录本总量逐渐下降的趋势,这表明精子成熟过程伴随着基因表达整体水平的降低。该研究发现精子细胞阶段表达的基因可细分为4个类别,包括2类转录下调的基因,1类转录先上调而后下调的基因,以及1类表达上调的基因。对这4类基因的深入研究将有助于我们了解人类精子成熟的调控机制。
通过单细胞转录组分析,研究团队发现人类精子细胞可分为四种类型(S1~S4)。进一步通过DDX4、TNP1、PRM1、PNA等标志分子的蛋白表达特征,证实人类睾丸中存在上述四种精子细胞类型。
05
人类睾丸的体细胞微环境
t-SNE分析发现人类睾丸中的体细胞主要分为三大类:支持细胞(ST)、MIX细胞、以及睾丸巨噬细胞(tMφ)。支持细胞中高度富集视黄酸合成相关基因(ALDH1A1),视黄酸通过旁分泌途径诱导精原细胞表达STRA8,使其进入减数分裂。而MIX细胞在基因表达水平上存在较大的异质性,通过t-SNE对MIX进行重新分群,发现MIX包含表达INSL3、DLK1的间质细胞和表达MYH11、ACTA2的管周肌样细胞。免疫荧光定位检测证实了人类睾丸组织中的体细胞微环境主要由支持细胞、间质细胞、管周肌样细胞和睾丸巨噬细胞共同形成。人类睾丸体细胞主要参与性激素合成、减数分裂的启动、细胞间的粘附与迁移,以及睾丸内的免疫反应,尤其是睾丸巨噬细胞,这类很少被关注到的细胞类型将为探索人类睾丸微环境稳态的维持提供新的研究思路。
06
单细胞转录组用于确定非梗阻性无精症患者的睾丸细胞类型和基因表达特征
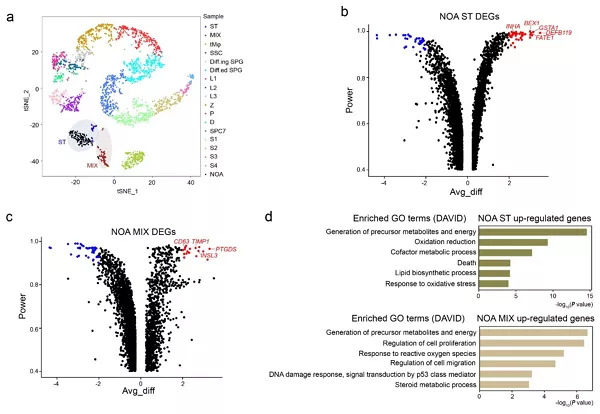
人类睾丸的单细胞转录组图谱的绘制,使研究者对非梗阻性无精症的深入研究成为可能。通过对一例非梗阻性无精症患者的174个睾丸细胞的单细胞转录组分析,发现这些细胞主要聚类到睾丸体细胞类型中的支持细胞和MIX细胞,对该例非梗阻性无精症患者的体细胞差异表达基因进行分析,发现了包括BEX1、FATE1在内的一系列可能与该疾病发生相关的差异基因(图6b,6c)。利用Gene Ontology(GO)对差异基因进行分析后发现,非梗阻性无精症患者的体细胞中高度富集细胞凋亡、氧化应激等生物学过程(图6d)。随后,免疫荧光染色结果证实了该例非梗阻性无精症患者睾丸组织中细胞凋亡表征明显。通过对该例无精症的探索,建立了基于单细胞转录组分析的无精症分子诊断平台,为研究不育症致病机制和临床诊断提供了新的思路。
图6. 无精症睾丸细胞的基因表达调控:(a)生精上皮完整男性的2,854个睾丸细胞及NOA患者的174个睾丸细胞组成的t-SNE图;(b)NOA患者与生精上皮完整男性支持细胞的差异基因火山图;(c)NOA患者与生精上皮完整男性MIX细胞的差异基因火山图;(d)NOA患者的睾丸体细胞上调基因中富集的生物学过程
综上,该研究在国际上首次成功绘制了人类精子发生的高精度单细胞转录组图谱,为人类精子发生、减数分裂调控机制的研究、无精症的分子诊断和临床治疗提供了全新的视角。
北京大学博士生柳溪溪、陈依东,南方医科大学汪妹博士,深圳大学常港博士,以及广州医科大学附属第三医院安庚博士为该论文的并列第一作者,北京大学汤富酬教授、乔杰教授、和南方医科大学赵小阳教授为该论文的共同通讯作者。此项工作得到国家重点研发计划、国家自然科学基金、广东省科技计划、北京未来基因诊断高精尖创新中心、以及中国博士后基金的支持。
End