Luminal型乳腺癌
【2126】徐莹莹教授:探寻阿喀琉斯之踵--乳腺癌诊疗四十年
2019年ASCO盛会于5月31日至6月4日在美国芝加哥召开。今年大会主题:Caring for Every Patient, Learning from Every Patient。值此盛会之际,《新见》栏目特邀乳腺癌领域专家学者共同推出六期ASCO-BC特刊,报道与点评乳腺癌领域热点。特刊第六期特邀中国医科大学附属一院徐莹莹教授就“Breast Cancer: 40 years of Research and Progress &Emerging system therapies:What’s new in 2019?”展开精彩回顾与点评。
中国医科大学附属一院乳腺外科 行政副主任
辽宁省特聘教授
中华医学会肿瘤学分会青委会副主任委员
中华医学会肿瘤学分会乳腺肿瘤青年学组 主任委员
中国抗癌协会乳腺癌专业委员会青委会 副主任委员
中国医师学会外科医师分会乳腺外科医师委员会青年委员
辽宁省抗癌协会临床细胞学专业委员会 副主任委员
MD Anderson Cancer Center 访问学者
《新见》是由中华医学会肿瘤分会乳腺肿瘤青年学组主办的国际会议期刊文献解读与点评专栏
医学行业知道癌症已经3000多年了,然而在这3000多年里,人类一直在敲打医学界的大门,求寻一个“治愈之方”。
--1937年3月《财富》杂志
公元前2625年,古埃及医者Imhotep接诊了一位患者:“乳房鼓起质硬肿块,密实如河曼果”。这位被誉为智慧之神的天才人物,在治疗一项下只写下寥寥数字:没有治疗方法。透过斑驳破碎的莎草纸,医者沉默下的束手无策令人扼腕。随着人类社会的进步,癌症被彻底地从历史的遮蔽中暴露出来,乳腺癌成为威胁女性健康的头号杀手。它宛如一个恶魔,疯狂而偏执,而这一场抗癌之战,亦是壮烈而执着。百十年来,科学家与医者、患者与亲友,前仆后继、从未停歇。令人振奋的是,在科学飞速发展的近四十年,乳腺癌死亡率下降了40%。纵使它仍像一个黑箱,人类依然不懈探索,不断完善系统治疗体系,为阴霾笼罩下的患者带去希望的曙光。2019年ASCO最具分量的奖项----戴维·卡尔诺夫斯基纪念奖授予了德克萨斯大学MD安德森癌症中心的Gabriel N. Hortobagyi教授,表彰其在乳腺癌治疗领域的贡献。让我们跟随Hortobagyi教授一同追溯近四十年乳腺癌诊疗发展的足迹……
七十年代:发轫之始,乳腺癌系统治疗雏形初现
千百年来,饱受这种疾病折磨的患者几乎成了任何可想象得到的实验对象。为了寻得某种有效的救治手段治疗这种棘手的疾病,无论田野、森林、药店、庙宇都被搜罗一空,几乎所有动物都无一幸免地做出了贡献。
--威廉·班布里奇(William Bainbridge )
要找到根除这一祸害的方法……只能留待偶然的尝试和未得协调的研究。
--1946年《华盛顿邮报》
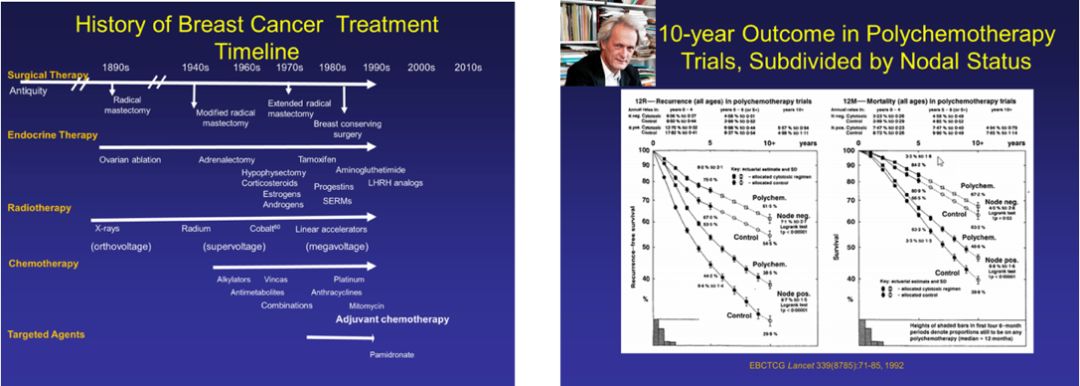
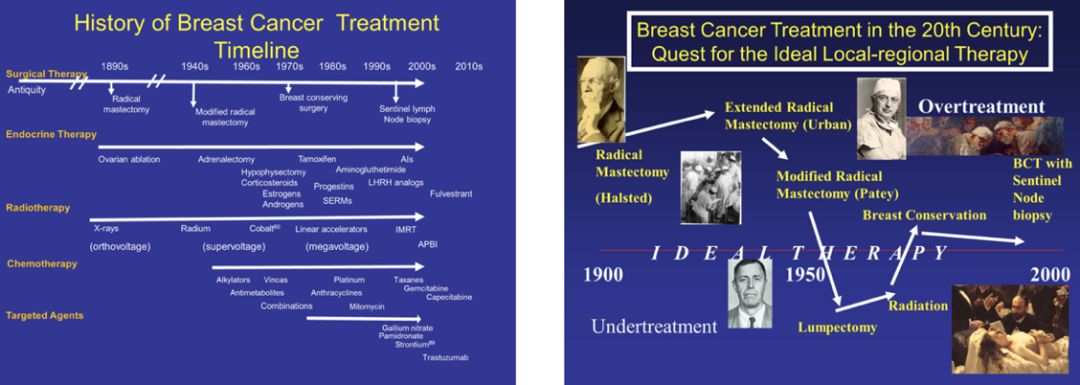
继Imhotep的病例记录被破解后,乳腺癌再次出现于公元前500年,大流士之妻、波斯皇后阿托莎发现乳房有一枚流血的肿块,由她的希腊奴隶执行了最原始的乳房切除术。中世纪的外科医生对乳腺癌虽略知皮毛,但深受“黑胆汁理论”影响,亦碍于术后感染的高死亡率,仅在穷途末路时才会切除肿瘤。随着麻醉与消毒技术的突破,1869年苏格兰医生Hoseph Lister带领一众外科医生再次普及肿瘤切除术,吹响了近现代乳腺癌治疗的第一声冲锋号。直至1894年,时任约翰霍普金斯医院外科主任的William Halsted提出了乳腺癌根治术,将乳腺癌切除的理念发挥到极致。正如其名,radical来源于拉丁文,意为根或极致,即将全部乳腺、相当范围的乳腺皮肤和周围组织,以及胸大、小肌和腋窝淋巴结全部清除。这一术式基于Halsted对乳腺癌扩散途径的理论:乳腺癌扩散遵循时间与解剖学规律,肿瘤细胞先发生局部浸润后、突破淋巴屏障向远处转移。该术式的推广大大降低了乳腺癌局部复发率,成为乳腺癌外科治疗领域最具划时代意义的里程碑。在Hasteld理论的影响下,扩大根治术应运而生,20世纪50年代发展至鼎盛。然而患者的生存期如常、并发症严重,均与扩大根治术所希冀的初衷背道而驰。20世纪50年代保留胸大肌和胸小肌的改良根治术I式和切除胸小肌、保留胸大肌的改良根治术Ⅱ式相继被提出,并称为乳腺癌改良根治术,与Halsted根治术的10年生存率相似。乳腺癌改良根治术凭借其功能及美容等方面的优越性,逐渐成为七十年代后期替代根治术的标准术式。
在外科医生为避免转移发生而不断扩大局部切除范围时,放疗出现,承诺以更小的损伤取得更大的疗效。1896年,芝加哥21岁的医学生Emil Grubbe用X射线成功使一名乳腺癌患者的复发肿瘤缩小。放疗这把热刀促使放射肿瘤学的产生,将癌症医学推进到原子时代。之后的数十年,放射源逐渐从X线、镭演变成Co60,放射距离、剂量与防护措施也逐渐改善,以在保证疗效的前提下减少对患者与医生的损伤。1962至1967年,哥本哈根试验中保乳手术联合术后放疗组与乳腺癌根治术组局部复发、5年及10年生存率相似。放疗在与其他治疗方式的不断竞争与合作中优化,逐渐在乳腺癌治疗领域占据一席之地。
然而,无论是冰冷的手术刀还是灼热的射线,都不能彻底阻止乳腺癌侵蚀生命的脚步。20世纪60年代,Fisher医生提出:乳腺癌是全身性疾病,在早期甚至亚临床阶段,肿瘤细胞便可通过血液循环扩散至全身。研究者们不得不收起专注于局部治疗的目光,系统治疗登上历史舞台。1967年,NSABP研究证实了噻替派在4枚以上淋巴结转移患者中的作用;1975年,Fisher引领的临床研究肯定了L-PAM在乳腺癌术后辅助治疗的价值。1976年,CMF方案在伴有1-3枚淋巴结转移的绝经前乳腺癌中获益显著,成为乳腺癌经典化疗方案。多项临床研究结果均强有力地证明了乳腺癌术后辅助化疗可有效提高患者生存期,成为乳腺癌系统治疗中不可或缺的手段。与此同时,1973年,Bonadonna G等发现接受阿霉素治疗的乳腺癌患者ORR达32%。同年,MD安德森癌症中心提出FAC化疗方案,蒽环类药物在乳腺癌中的作用逐渐引起人们注意。新的化疗药物不断研发,然而部分患者的局部晚期状态限制了手术的实施,将化疗用于手术之前是否可行?1958年,NSABP探索了围手术期单药噻替派对乳腺癌患者复发及生存的影响;1973年米兰癌症研究所的临床试验表明,局部晚期乳腺癌患者术前化疗的客观反应率达75%,使部分原本不适宜手术的患者转变为可手术,新辅助化疗成为乳腺癌系统治疗的新选择。
1896年,苏格兰外科医生George Beatson从切除卵巢而减少泌乳的奶牛得到启发,对三名乳腺癌患者实施卵巢切除术,乳腺肿瘤缩小,这一尝试正式拉开了乳腺癌内分泌治疗的序幕。1923年,Allen Doisy发现雌激素;1968年Elwood Jensen发现雌激素受体;1971年,在避孕等多种治疗适应症尝试中频频受挫的选择性雌激素受体调节剂他莫昔芬(TAM)在乳腺癌治疗中绝处逢生。1973年,HW Ward对68名晚期乳腺癌患者行TAM治疗,有效提高了肿瘤反应率,且毒副反应较低。经此一役,TAM成为晚期乳腺癌的标准用药。
直至1974年,以根治术为主,钴60放疗、烷化剂和CMF方案化疗以及内分泌治疗为辅的乳腺癌系统治疗模式初步形成,乳腺癌诊疗踏上了快速进阶之路。
八十年代:探赜索隐,寻求更优乳腺癌诊疗模式
统计是这代人的宗教信仰,是它的希望,也是它的救赎。
--格特鲁德·施泰因(Gertrude Stein)
完善的疗法尚未形成。我们大多数人都相信它不会是杀死细胞的毒性治疗,这就是为什么我们支持针对肿瘤生物学的各种基础性研究以追求更根本的了解。但……我们必须就现有的一切尽最大的努力。
--布鲁斯·凯伯纳致罗斯·库什纳
在肿瘤早发现、早诊断及早治疗的“三早”理念引领下,钼靶X线乳房摄影普及应用,使早期乳腺癌比例逐渐增多。超声、CT、MRI的相继应用,构建了乳腺影像学筛查系统,极大提高了乳腺癌诊断的及时性和准确性;空心针穿刺活检及细胞学病理为优化诊疗方案奠定了基础。
缩小手术范围、提高患者生活质量的需求与良好的预后是否可以得兼?随着对乳腺癌本质的深入认识,全身性疾病理念在研究者心中生根发芽。1985年,NSABP-B04研究十年随访结果表明,无论腋窝淋巴结阴性或阳性患者,单纯乳房切除联合/不联合放疗与乳腺癌根治术的DFS与OS均无差别。随后,NSABP-B06、Millan I、NCI、EORTC及IGR等研究相继证实了保乳手术的可行性。
七十年代末至八十年代初,NSABP-B11等研究表明含蒽环类的CAF、AC方案优于CMF方案,肯定了蒽环类药物在辅助化疗中的作用。1988年,NSABP-B18试验入组了可手术的乳腺癌患者,比较AC*4化疗后手术与手术后AC*4辅助化疗对预后的影响,结果显示两组的DFS与OS无显著差别,新辅助化疗向优化个体化治疗策略迈进一步。化疗的普及使得相应支持治疗随之发展。八十年代中期,昂丹司琼等止吐药与止痛药用于肿瘤治疗;八十年代末期,造血干细胞、G/GM-CSF等支持治疗相继应用,有效减轻了患者的痛苦。
他莫昔芬继七十年代在晚期乳腺癌首战告捷后,八十年代陆续取得喜人结果。1984年,Wiegele J发现TAM可有效提高绝经前激素受体阳性MBC的客观缓解率;1985年,克里斯蒂医院研究表明TAM术后辅助治疗显著延长乳腺癌复发间期、降低远处转移风险。同年9月,在马里兰召开的NIH共识发展会议上,TAM被推荐用于腋窝淋巴结转移和激素受体阳性乳腺癌治疗。内分泌治疗也并非TAM一枝独秀,1983年,Powles TJ报道了芳香化酶抑制剂在转移性乳腺癌,尤其是骨转移患者中的作用。内分泌治疗作为靶向治疗的探路者,成为乳腺癌分类治疗的先行者。
癌症之所以拥有强大的破坏力,是因为肿瘤细胞在克隆中不断演化,每一代少量的突变使它们在药物和免疫系统的多重攻击下仍有适者生存,同人类一样,这种疯狂的疾病也是达尔文式选择的结果。各种各样的治疗手段依然无法根除疾病,在肿瘤基因层面的探索迫在眉睫。八十年代初期,MCF7等乳腺癌细胞系以及动物模型的建立为基础研究提供了平台,学者们对ESR1、EGFR、HER2、c-MYC等基因进行深入研究。1982年,麻省理工学院的Robert Allan Weinberg教授和孟买科学家LaKshmi Charon Padhy从老鼠神经母细胞瘤中分离出另一种致癌基因,命名为 neu 基因;1984年,德国科学家Axel Ullrich发现并命名neu的人类同源基因HER2。1986年,Dennis Slamon教授应用HER2探针检测了189例原发乳腺癌患者组织样本,发现30%伴有HER2扩增,且与更差的DFS、OS相关,首次提出HER2基因是乳腺癌生存的独立预后因子,并通过体内外实验阐明HER2促进乳腺癌细胞增殖转移的作用,为靶向治疗奠定了理论基础。这一时期,对细胞周期异常与乳腺癌发生发展的关系,乳腺癌转移、耐药机制的探索在磕磕绊绊中步入正轨。在这场与乳腺癌对抗的持久战中,终于燃起了科学探索的第一束火苗,带领人类在迷途中找寻前行的方向。
九十年代:有的放矢,乳腺癌靶向治疗崭露头角
针对人类癌症的问题,当务之急除了寻找一种广谱治疗法之外,还需要找到一种方法,在癌症呈现临床表征之前就发现它的存在。
--西德尼·法伯(Sidney Farber)
知己知彼,百战不殆;不知彼而知己,一胜一负;不知己不知彼,每战必殆。
--孙子兵法
八十年代末期对乳腺癌的了解仍集中于表象,使诊治陷入了瓶颈。1992年美国放射学会发布了第一版“乳腺影像报告和数据系统”(Breast imaging reporting and data system)并分别于1995和1998年完成了第二、三版修订,将BIRADS分级系统用于乳腺X线诊断,为乳腺影像诊断奠定了规范化基础。与此同时,99mTc-MIRI、201铊等可用于原发乳腺癌探测和肿瘤复发诊断的新型放射显像技术蓬勃发展。99mTc-MIRI鉴别乳腺良恶性肿瘤的灵敏度和特异度高达85%与81%,并能显示转移淋巴结,为前哨淋巴结活检(SLNB)的开展与乳腺癌手术方案选择带来新的契机。
1994年,Giuliano率先提出将SLNB作为早期乳腺癌的腋窝分期方式引入乳腺外科治疗。随后,NSABP-B32研究证实对于SLNB阴性的患者,进一步行腋窝淋巴结清扫(ALND)并未取得局部复发及生存获益,该研究确立了SLNB阴性患者避免腋窝清扫的标准。后续的IBCSG 23-01研究肯定了前哨淋巴结1-2枚微转移患者SLNB的可行性;ACOSOG Z0011研究证实,对于行保乳术的T1-T2患者,前哨淋巴结1-2枚宏转移可不进行ALND;AMAROS研究表明,前哨淋巴结1-2枚宏转移患者,腋窝放疗可代替ALND。这些研究进一步推动了SLNB的实施和发展,使其成为继保乳术后外科领域的第二次革命。
九十年代,紫杉类药物接连获批转移性乳腺癌的解救治疗,淋巴结阳性乳腺癌的辅助治疗,与赫赛汀联合用于HER2阳性乳腺癌的一线治疗适应症。NSABP -B32、CALGB 9344研究中,腋窝淋巴结转移患者应用蒽环联合紫衫化疗显著降低复发风险。然而,化疗由于缺乏特异性导致的毒副反应,使其在大规模治疗中停滞不前。人们逐渐意识到,寻找肿瘤特异性靶点、研发有的放矢的靶向药物才是攻克肿瘤的方向。
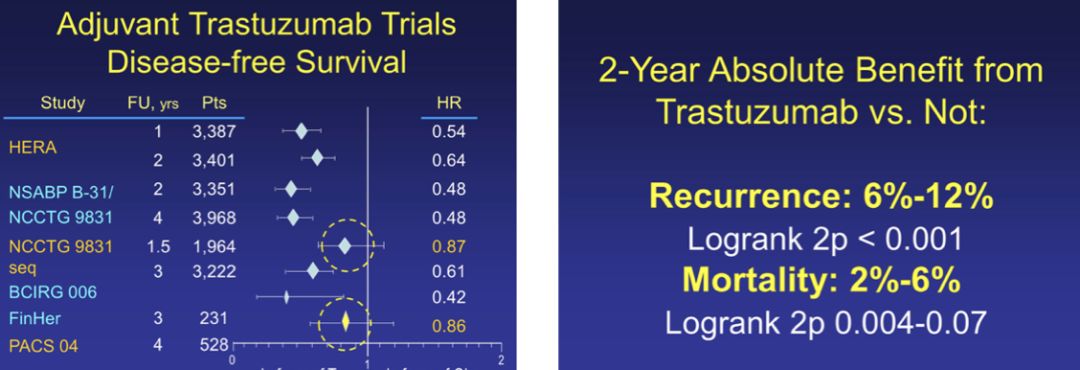
1990年,第一个靶向HER2的人源化单克隆抗体----曲妥珠单抗问世,开启了乳腺癌生物靶向治疗的新时代。正如其商品名赫赛汀(Herceptin)所融合的HER2、拦截(intercept)和抑制剂(inhibitor)三重含义,曲妥珠单抗充满了机遇与挑战。1995年,H0684g研究入组了469例未经治疗的HER2阳性转移性乳腺癌,随机接受标准化疗或化疗联合曲妥珠单抗治疗,中位随访30个月结果表明,联合曲妥珠单抗组ORR提高18%,死亡风险降低20%,总生存期延长5个月。基于该结果,1998年,FDA批准曲妥珠单抗用于HER2阳性转移性乳腺癌治疗。NSABP-B31、NCCTG 9831、HERA、BCIRG006四项前瞻性研究入组超过13000例HER2阳性早期乳腺癌,比较单纯化疗与化疗联合靶向治疗对预后的影响,结果表明一年曲妥珠单抗辅助治疗显著降低复发和死亡风险,奠定了曲妥珠单抗在HER2阳性早期乳腺癌辅助治疗的基石地位。
21世纪:分类而治,乳腺癌治疗规范化、个体化、精准化之路
癌症研究的革命,一言以蔽之就是:癌症,本质上是一种基因性疾病。
--伯特·福格尔斯坦
今天晚上,我要启动一个新的“精准医学计划”。这一计划将使我们向着治愈诸如癌症和糖尿病这些顽症的目标迈进一步,并使我们所有人,都能获得自己的个体化信息--我们需要这些信息,使我们自己和家人更加健康。
--巴拉克·奥巴马(Barack Obama)
人类认识到癌症本质上是一种基因性疾病,希望窥探到肿瘤分子层面特征。1999年,NCI提出肿瘤分子分型概念,实现了肿瘤由形态学向分子特征分类的转变。2003年“人类基因组计划”完成,基因检测进入临床实践。2011年,美国国家科学院提出“精准医学”概念,推动了个体化诊疗的蓬勃发展。
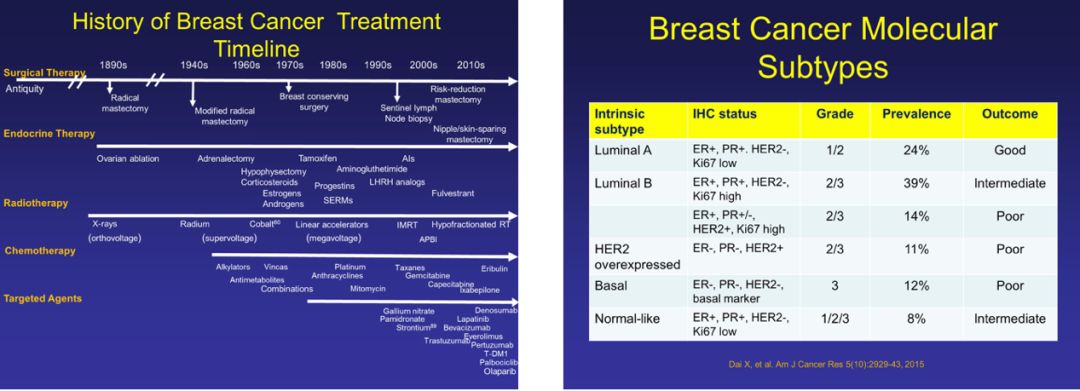
2000年,斯坦福大学Peuro团队采用包含8102个基因的cDNA芯片分析42个不同个体的65个乳腺癌标本基因表达特征,首次提出乳腺癌分子分型概念。2001年,Sorlie等将乳腺癌分为Luminal A、Luminal B、HER2阳性、Basal like、Normal breast like五种类型,成为乳腺癌分子分型的研究基础。其中,除Normal breast like型可能由标本中正常组织污染所致外,其余4种类型在后续的研究中均证实了与临床及预后的特异性。由于基因表达谱分析价格昂贵,临床应用受限,2011年St. Gallen国际乳腺癌专家共识认可了临床中以免疫组化技术替代分子技术进行近似的分子分型,并将增殖细胞核抗原(Ki-67)作为补充分型指标。2013年St. Gallen会议又对PR、Ki-67等界值进行修订,成为当今乳腺癌的分类标准和治疗依据。
Luminal型乳腺癌是激素受体阳性、内分泌治疗敏感型乳腺癌。21世纪以来内分泌治疗模式日新月异:对于早期中高危患者,辅助内分泌治疗采取“加法”策略;对于没有内脏危象或疾病快速进展的晚期患者,内分泌治疗成为优选方案。
绝经前中高危患者联合卵巢功能抑制辅助内分泌治疗已成标准(TEXT&SOFT);绝经前患者延长辅助内分泌治疗的数据仍不充分(仅ATLAS、aTTom中小样本人群);绝经后患者延长内分泌治疗研究众多(NSABP-B42、MA17、DATA、IDEAL、SOLE、AERAS等),但结论不一,目前认同选择远期复发风险高、内分泌治疗敏感、毒副反应可耐受人群进行延长治疗。那么,如何筛选获益人群?今年ASCO会议公布的Trans-aTTom研究,通过BCI指数的H/I比值探究延长内分泌治疗的优势人群。结果发现,H/I高的患者10年较5年TAM治疗,RFI提高9.8%;而H/I低的患者没有获益,这也提示未来预测工具在临床决策中的价值。
随着CDK4/6抑制、mTOR抑制剂、PI3K抑制剂等药物的问世,“靶向+内分泌”治疗模式正迅速改变HR+/HER2-晚期乳腺癌的治疗格局。尤其是CDK4/6抑制剂(Palbociclib、Ribociclib、Abemaciclib),凭借在PALOMA、MONALEESA及MONARCH系类研究中的出色表现备受瞩目,成为各大指南的一线/二线推荐策略。MONALEESA-7研究首次将Ribociclib应用至绝经前患者,并于2018年获批成为首个一线治疗绝经前转移性乳腺癌的CDK4/6抑制剂。本届ASCO会议公布了MONALEESA-7中位随访42个月的结果,Ribociclib联合治疗组的生存率达70.2%,显著高于单纯内分泌治疗组。另外,CDK4/6抑制剂也开始在新辅助内分泌治疗领域进行尝试(PALLET、NeoPalAna、N007等),前景可期。同时其在与免疫检查点抑制剂、抗HER2治疗以及其他靶点药物联合中也展现出潜力。
随着基因检测进入临床实践,使部分HR+/HER2-患者豁免化疗成为可能。Oncotype DX、MammaPrint是目前指南推荐力度最强、认可度最高的多基因检测工具。2017年,TAILORx研究中位随访7.5年的结果表明,RS 11-25分的中风险人群,单纯内分泌治疗与联合化疗相比,IDFS(83.3% vs. 84.3%)、DRFI(94.5% vs. 95%)、OS(93.9% vs. 93.8%)相似,尤其是50岁以上患者可免于化疗。MINDACT试验采用Adjuvant! Online进行临床风险评估,MammaPrint进行基因风险评估,临床高风险/基因低风险患者化疗与否生存无差别。70基因检测成为唯一获批指导1-3枚淋巴结阳性早期乳腺癌治疗决策的工具。
三阴性乳腺癌
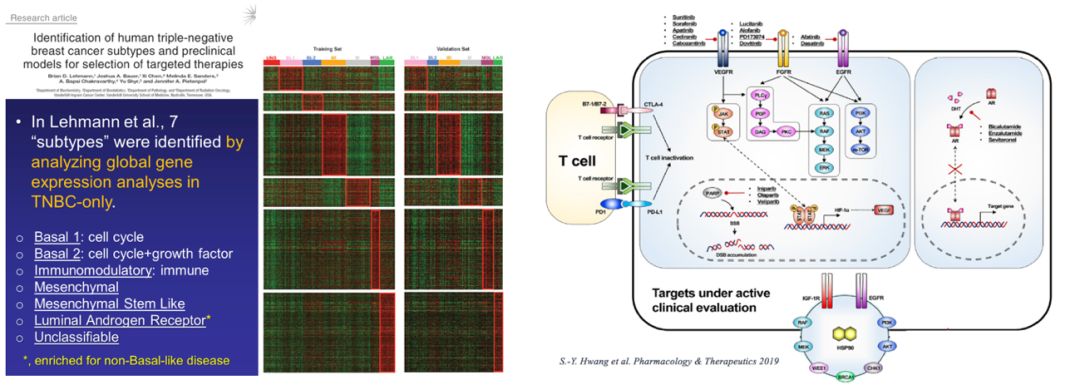
三阴性乳腺癌(TNBC)异质性强,缺乏特异性靶点,化疗是其主要治疗手段。而一旦发生耐药,则迅速出现复发转移,迫切需要寻找治疗靶点为TNBC提出新的治疗策略。20世纪以来主要集中于TNBC分子分型的探索。2011年范德堡大学Lehmann教授通过对587例TNBC患者的基因芯片数据进行聚类分析,最早将TNBC分为BL1、BL2、IM、M、MSL、LAR七种亚型。2019年,复旦大学团队通过对465例原发性TNBC样本进行高通量基因芯片和测序分析,将TNBC划分为四种亚型,包括腔面雄激素受体型、免疫调节型、基底样免疫抑制型以及间充质型,并深入分析了各个亚型的临床意义和治疗策略。TNBC的分子分型推动了靶向治疗的实施。
虽然众多靶向新药在TNBC的研究中遭遇滑铁卢,但近两年来,以PARP抑制剂和免疫检查点抑制剂为代表的靶向治疗依然取得了突破性进展。基于OlympiAD、EMBRACA研究结果,PARP抑制剂对比传统化疗显著延长PFS且毒副反应更低,2018年Olaparib、Talazoparib相继获FDA批准用于胚系BRCA1/2突变、HER2阴性的转移性乳腺癌。免疫治疗在众多实体肿瘤治疗中取得令人欣喜的成果,为TNBC带来了曙光。IMpassion130是一项随机、双盲、安慰剂对照临床研究,对比了Atezolizumab(PD-L1单抗)联合白蛋白紫杉醇与安慰剂联合白蛋白紫杉醇,一线治疗局部晚期或转移性TNBC的疗效和安全性。本次ASCO会议公布了第二次中期分析OS数据,在PD-L1阳性的晚期TNBC患者中,Atezolizumab联合白蛋白紫杉醇治疗组与对照组相比,总生存提高7个月。2019年,Atezolizumab成为首个获批上市的PD-L1抑制剂,免疫治疗被写入临床指南。在通往TNBC “分类治疗”的道路上筛选(细化分子分型)、甄别(寻找疗效预测指标)与开发(新靶点与新药物)缺一不可。
HER2阳性乳腺癌
HER2阳性乳腺癌是一类侵袭性强、非常凶险的亚型。曲妥珠单抗的问世极大地改善了这类患者的预后,但仍有20-30%复发转移。帕妥珠单抗、拉帕替尼、来那替尼、吡咯替尼等药物开辟了抗HER2治疗的新格局。2014年,CLEOPATRA研究以56.5个月的中位OS奠定了曲妥珠单抗联合帕妥珠单抗双靶一线治疗的地位,今年ASCO会议公布了99个月的随访结果,双靶治疗仍持续生存获益。2017年,APHINITY研究在标准化疗联合曲妥珠单抗辅助治疗的基础上增加帕妥珠单抗,4年iDFS提高1.7%,尤其是激素受体阴性、淋巴结阳性的高危人群获益更多。在新辅助治疗中,无论是曲妥珠单抗联合帕妥珠单抗(NeoSphere),还是曲妥珠单抗联合拉帕替尼(Gepar-Quattro、NeoALLTO),双靶治疗均显著提高了患者的pCR率,获得更优的PFS。从单靶到双靶治疗模式的转变,为更多HER2阳性乳腺癌患者带去治愈的希望。小分子酪氨酸激酶抑制剂(TKI)也表现不俗。今年ASCO公布了NALA试验结果,在经历了曲妥珠单抗、帕妥珠单抗和/或T-DM1等二/三线治疗后,来那替尼联合卡培他滨依然可以降低24%的复发死亡风险。来自我国的III期临床研究表明,对于曲妥珠单抗及紫杉类药物治疗失败的转移性乳腺癌,吡咯替尼联合卡培他滨较单药卡培他滨显著延长PFS 7个月。
关于HER2阳性乳腺癌治疗“More or Less”的讨论始终不断,如抗HER2治疗的最佳疗程、最佳时机以及单靶或双靶的最佳组合……本届ASCO会议报道了APHINITY研究的生物标志物分析结果,免疫标志物表达水平越高,HER2过表达也越高,越能从双靶治疗中获益;HER2基因瘤内异质性(ITH-HER2)是双靶治疗pCR的预测因子。更多有效的预后及疗效预测指标将推动HER2阳性乳腺癌向精准治疗迈进。
放眼未来:攻瑕蹈隙,以患为师,开创乳腺癌治疗新纪元
在帕特洛克罗斯的故事中,没有幸存者,甚至连阿喀琉斯也没有活下来。
--路易丝·格鲁克(Louise Gluck)
癌症起于人,亦止于人。科学的抽象概念,有时候可能会使人忘记这样一项基本的事实----医生治疾,但也治人。而有时候,他们职业的这一前提,会同时把他们往两个方向推。
--古德菲尔德(June Goodfield)
乳腺癌诊疗四十年,经历了从宏观到微观、从泛化到细化的演进过程。随着分子生物学技术的迅猛发展,未来将走向多组学多维度分型,从而进一步认识乳腺癌复杂的生物学特性。通过筛选有效的疗效预测生物标志物,阐明乳腺癌靶向耐药机制,研发新型靶向药物,有效利用基因预测及筛查工具,发展免疫治疗及增强免疫活性等,从肿瘤自身及肿瘤微环境出发,拓展乳腺癌精准治疗版图。
而在挖掘疾病本质、提升治疗疗效的同时,也不要忘记医者仁心,以人为本。2019年ASCO会议以“爱患如己,以患为师”(Caring for Every Patient,Learning from Every Patient)为主题,将肿瘤的诊疗中心转移至患者身上。什么才是高质量的治疗?怎样才能给患者风险收益最佳的临床决策?我们要了解和尊重病人的意愿与需求,共同制定最佳的个体化治疗方案;要注重患者的体会和感受,通过对疾病的“全方位、全周期”管理提高治疗效果、提升生活质量。
从七十年代至今,我们欣喜的看到,乳腺癌的五年无局部复发生存率、无区域复发生存率以及无远处转移生存率分别提高了16%、60%和170%,死亡率从31.8/10万下降至21.3/10万。然而与乳腺癌的博弈依然道阻且长,一代又一代的肿瘤医生坚信即便癌症顽强如古希腊神话中半人半神的武士阿喀琉斯,也有“脚踝”一处可以致命,让我们在探寻阿喀琉斯之踵的道路上相互扶持、结伴前行……
敬请关注《新见》ASCO-BC特刊
第一期:
复旦大学肿瘤医院余科达教授:NSABP clinical trials in early breast cancer: A 60-year odyssey
第二期:
北京大学肿瘤医院邵彬教授:Biomarker analysis of the APHINITY trial
浙江省肿瘤医院郑亚兵教授:Genomic markers in the PALOMA-3 trial
第三期:
广东省中医院大学城医院陈前军教授:Adjuvant Targeted Therapy: When Is More Better?
中山大学肿瘤防治中心史艳侠教授:TALA in Breast Cancer
第四期:
福建省立医院叶松青教授: GeparOLA: A randomized phase II trial
吉林大学第一医院宋东教授:Biomarkers in BC: BRCA/HRD/PD-L1
第五期:
武汉同济医院李兴睿教授:What is the role of surgery in metastatic breast cancer?
天津肿瘤医院王忱:CDK4/6 inhibitors:Optimizing Care in ER-positive Breast Cancer
第六期:
中国医科大学附属第一医院徐莹莹教授:Breast Cancer: 40 years of Research and Progress &Emerging system therapies:What’s new in 2019?
精彩回顾
【新见】徐莹莹教授&邢鹏教授:剂量密集型化疗在靶向治疗时代的价值
【新见•ASCO特刊】余科达教授:NSABP乳腺癌研究60年奥德赛之旅
【新见•ASCO特刊】郑亚兵教授:PALOMA-3:ER+晚期乳腺癌患者在氟维司群联合/不联合哌柏西利治疗中早期进展的基因组标记物
【新见•ASCO特刊】叶松青:GeparOLA Ⅱ期临床研究: 奥拉帕利联合紫杉醇对比紫杉醇/卡铂并序贯表阿霉素/环磷酰胺用于HRD阳性,HER2阴性的早期乳腺癌患者新辅助治疗的疗效
【新见•ASCO特刊】史艳侠教授:TALA in Breast Cancer
【新见•ASCO特刊】李兴睿教授:晚期乳腺癌患者的手术意义探讨