中国学者首次对贺建奎事件发表正式学术评论:存在严重科学问题,感到极其愤怒
今日凌晨,两位中国学者在 PLOS Biology 发表观点文章,对贺建奎基因编辑婴儿事件进行学术性评论。这是 2018 年 11 月底贺建奎公布基因编辑婴儿诞生后,中国学者首次从科学原理、实验设计和数据的角度,在学术期刊上发表正式同行评议文章,针对这一震惊全球的科学事件发声和表态。
文章的两位作者均为活跃在基因编辑领域的学者:中科院动物研究所研究员王皓毅和中科院神经科学研究所研究员杨辉。两人都是胚胎基因编辑方面的专家,多次在 Cell、Nature Biotechnology、Cell Research 等重要期刊发表论文。
王皓毅对“科研圈”表示:“去年这件事情发生之后,我们基因编辑领域的同行都非常愤怒。目前已经有很多针对伦理问题的文章和讨论了,但是作为基因编辑领域的研究者,我们希望能够从科学和技术的角度讲清楚为什么我们认为这个所谓的研究工作是非常错误的。正好也受到 PLOS Biology 邀请,所以我就和杨辉一起写了这篇文章。”杨辉也认为,“从专业角度来说,我们更适合评价这一事件科学层面上的东西。”
据了解,这篇文章在提交后接受了由期刊编辑选定的外部专家的审稿,两位作者也表示审稿意见非常中肯和有建设性。当“科研圈”提出,这篇文章能否代表国内基因编辑学者对贺建奎基因编辑婴儿事件的看法时,两位作者表示:因为没有正式发表的论文,他们只能根据贺的报告内容进行评估;对于具体的科学和技术细节,可能还有有待其他同行可以补充的地方;但是对于此事的整体判断,可以说是“国内外基因编辑领域学者共同的声音”。
这篇文章也在某种意味上体现了科学共同体对贺建奎基因编辑婴儿事件的态度和决心。“科研圈”对这篇文章进行了全文翻译,希望能为所有关心这一事件的读者提供更加准确的信息与参考。
*文章原标题为Gene-edited babies: What went wrong and what could go wrong(点击标题进入原文页面),享有 CC BY 4.0 开放版权协议。 译文未经原作者审校,文中小标题和配图均为译者添加,如有不尽之处,敬请指正。

基因编辑婴儿:已经出现的问题以及可能存在的风险
王皓毅1,2,3 杨辉4,5,6
1 中国科学院动物研究所干细胞与生殖生物学国家重点实验室,2 中国科学院干细胞与再生医学创新研究院,3 中国科学院大学,4 中国科学院上海生命科学研究院神经科学研究所神经科学国家重点实验室,5 中国科学院脑科学与智能技术卓越创新中心,6 上海脑科学与类脑研究中心
2018 年 11 月 25 日,时任南方科技大学副教授的贺建奎宣布,两名携带经过编辑的 CCR5 基因的婴儿已经在中国诞生(译者注:南科大在 3 个月后宣布与贺建奎解除劳动关系)。他宣称,这个基因修正将让婴儿对 HIV 病毒感染免疫。11 月 28 日,贺在第二届国际人类基因组编辑峰会上展示了项目实验数据。尽管目前实验的基本证据仍未披露,相关声明的真实性仍不明确,贺在峰会上展示的实验设计和数据已经暴露出严重的科学问题和伦理问题。作为来自中国基因编辑领域的研究人员,我们对这一事件感到十分震惊。贺的工作看起来是秘密进行的。根据我们目前所了解的信息,贺从未在基因编辑领域发表过有影响力的科研论文,在中国的基因编辑学界也并不活跃。我们对这起极端不负责任的行为感到极其愤怒,这明显违反了中国乃至全世界各个国家的法律法规和医学伦理。在此,我们假设贺展示的数据是真实的,并从科学的角度对该实验做出评价。因为我们相信,如果要对这次事件进行负责任的审查和讨论,必须充分了解其中的科学事实。
2018 年 11 月 28 日,贺在第二届国际人类基因组编辑峰会上展示项目实验数据。图片来源:bbc.com
实验本身的合理性存疑
首先,我们要批评实验的整体理念。贺宣称,对 CCR5 基因进行编辑是为了避免婴儿感染 HIV 病毒,因为孩子的父亲是 HIV 携带者(母亲不携带病毒)。但是,要想避免 HIV 传染给胎儿,在胚胎中进行基因编辑是完全不必要的。HIV 阳性的父亲可以通过完善的辅助生殖技术(Assisted Reproductive Technology,ART)孕育健康的后代,这一技术有极高的成功率 [1]。至于未来对 HIV 感染的防范,只要避免可能的 HIV 暴露风险,对大多数人来说就足够了。因此,编辑早期胚胎不能给婴儿带来好处,却在多方面带来了潜在的严重风险,接下来我们将讨论这部分内容。
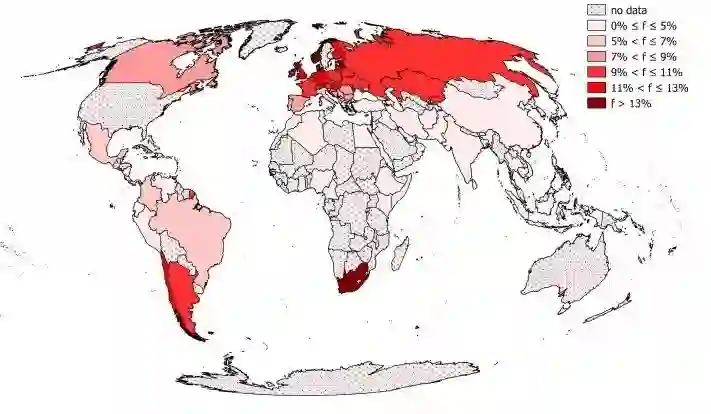
CCR5 基因编码白细胞上的一个受体蛋白,HIV-1 利用它和另一种受体感染人体细胞。某些特定欧洲人群携带一个自然发生的等位基因 CCR5Δ32,尽管携带该基因的杂合与纯合个体的 HIV 感染都发展得更缓慢,或者对 HIV 感染免疫 [2,3],但是就算是纯合个体,也能被某些 HIV 毒株感染[4]。携带 CCR5Δ32 的个体总体上是健康的,但这个等位基因在非欧洲人群中出现的概率极低,并且中国人群中目前仍未发现纯合个体 [5,6]。因此,很难预测将 CCR5Δ32 或其他 CCR5 等位基因突变引入中国遗传背景的风险。尽管贺宣称他准备了长期的健康追踪计划,没有细节信息表明谁会对此提供资金支持,也不清楚当医疗事故发生时如何进行责任评估。
CCR5Δ32基因分布比例。
图片来源:Frequencies of gene variant CCR5-Δ32 in 87 countries based on next-generation sequencing of 1.3 million individuals sampled from 3 national DKMS donor centers
实验整体科学水平堪忧
接下来,我们将讨论贺的数据。贺一开始展示了 CCR5 基因敲除小鼠的数据,以评估“在胚胎期通过 CRISPR/Cas9 基因编辑技术敲除 CCR5 是否会造成预期外的遗传学、生理学或行为学影响”(引号中内容直接引用自贺的展示幻灯片)。这太荒唐了。仅仅通过对比四个不同组织的组织学染色结果,而不进行量化评估,再加上两个简单的小鼠行为学实验,不可能回答以上问题。
这项研究的科学水平很低,并且流于表面。例如,新奇物体探索行为测试(novel object investigation behavior test)的数据显示,尽管 P 值大于 0.05(译者注:这代表两组数据在统计学上没有显著差异),但野生型小鼠和 CCR5 敲除小鼠的表现仍存在明显差异。为了证明 CCR5 敲除不会产生任何行为表型,需要在更大的样本中进行进一步评估。简单进行文献搜索就能发现,CCR5 编码的蛋白是一个趋化因子受体,具备正常的免疫功能,而 CCR5 敲除小鼠的自然杀伤细胞相关表型会导致多种病毒感染风险增加[7-9]。
混乱的编辑结果和被低估的风险
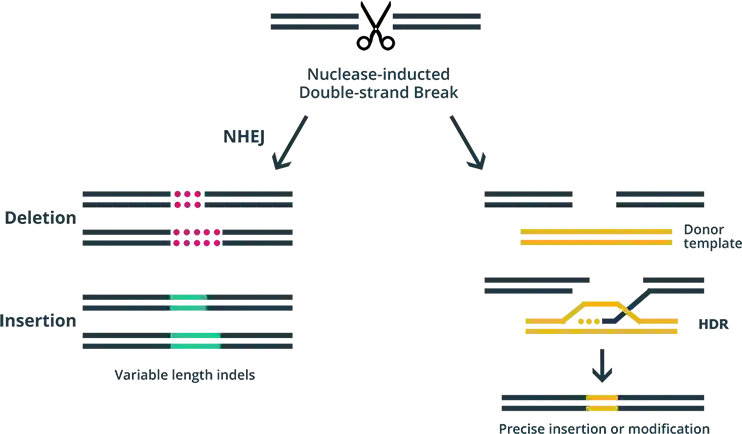
接下来,贺设计了多个单链向导 RNA(single-guide RNAs, sgRNAs),并在人类细胞系和猴子胚胎中测试了它们的有效性——这在基因编辑实验中是很常见的操作。CRISPR-Cas9 编辑系统被送进细胞后,其基因组靶点上的 DNA 双链继而发生断裂。随后DNA修复系统开始工作,这时参与修复的可能是非同源末端连接(nonhomologous end joining, NHEJ)修复,或者同源介导/重组修复(homology-directed repair, HDR)。NHEJ 常会导致一小部分碱基的插入或缺失(indel),但 HDR 能在编辑靶点完成对断裂 DNA 的完美修复或精确修改。
DNA双键断裂后的两种修复模式。图片来源:emendobio.com
贺的展示中只对 NHEJ 修复导致的碱基插入或缺失做了描述,但是我们没有看到任何数据反映出能产生 CCR5Δ32 的 HDR 修复。这说明贺原本的实验目的并不是创造 CCR5Δ32。据我们所知,除了 CCR5Δ32 之外,人体中其他天然突变的 CCR5 indel 等位基因并不常见。以往的研究发现,两个 CCR5 等位基因均突变的个体表达的、可稳定存在的截短型 CCR5Δ32 蛋白可能参与 HIV 感染免疫表型的出现[10]。因此在考虑基因编辑带来的益处与风险时,我们不能把其他种类的 CCR5 突变和 CCR5Δ32 混为一谈。此外,没有改变三联体密码子读码框的基因编辑也很可能产生功能获得性突变,其风险更加难以预测。
贺建奎还试图利用猴子受精卵进行了显微注射方法的优化,并且通过测序评估了基因编辑的效力和细胞嵌合水平(译者注:基因编辑可能会导致一个胚胎中的不同细胞各自具有不同的基因型,这种现象被称为嵌合体)。由于他的数据未被任何期刊或出版平台正式发表,PPT 展示出的内容不足以让我们下定论。我们只能说,根据他在会议上的展示,猴子胚胎实验中的嵌合体问题并没有得到解决。
接下来,贺建奎开始给人类胚胎实施显微注射。根据他的数据和之前的研究, 用 Cas9 蛋白代替 Cas9 mRNA,在减数第二次分裂中期(metaphase II, MII)注射进胚胎能够减少嵌合体的比例,但并不能完全避免嵌合现象发生[11,12]。而且这种策略只在 NHEJ 介导的基因敲除中有用,对于 HDR 介导的精确基因修复则不然。虽然目前已经出现了很多在细胞水平增强 HDR 修复的方法[13],但是这些方法能否用于人类胚胎还是个未知数。
Mitalipov 课题组的研究显示母源等位基因是修复过程的模板,能够修正病理性突变[12]。但其他课题组并不同意这一观点:Cas9 可能会导致大范围的碱基删除或重排,而且导致以 PCR 为基础的基因分型检测得到假阳性结果(译者注:这里的假阳性意味着实际上没有被成功编辑的基因,但在检测过程中被认为成功达到了编辑目的)[14]。上述争论传达了这样的事实:目前学界对于 DNA 修复机制、人类早期胚胎基因编辑的后果的理解仍然不全面,也反映出贺很可能低估了嵌合体的发生率,也低估了基因改造带来的风险。
未被解决的脱靶和中靶突变
为了评估编辑脱靶所造成的突变,贺建奎用经过编辑的人类胚胎建立了一个人类胚胎干细胞(human embryonic stem cell, hESC)系。这项实验的科学质量又一次没有达标。他从一个经过编辑的胚胎中只得到了一个 hESC 系,随后它被用来进行全基因组测序(whole-genome sequencing, WGS),以检测潜在的脱靶突变。在 hESC 的分离和扩增过程中,可能会发生许多遗传变异 [15]。因此,为了识别出真正由基因编辑脱靶导致的突变,需要从经过编辑和未经过编辑的胚胎中取出细胞建立多个 hESC 系,进行深度测序和大量的生物信息学分析。
贺进一步宣称,他对 19 个经过编辑的人类囊胚的植入前遗传诊断(preimplantation genetic diagnosis , PGD)样本进行了单细胞全基因组测序,以评估基因编辑的中靶(on-target)和脱靶情况,然后才决定哪些胚胎可以植入母体。19 个胚胎中有 12 个含有 CCR5 野生型等位基因,表明 CCR5 在这些胚胎中未得到完全编辑。重要的是,目前还没有成熟可靠的单细胞全基因组测序技术能够评估脱靶突变 [16]。这项技术需要借助全基因组扩增,将基因组中的单个拷贝扩增到足够的量,这一过程会引入许多人为突变 [16]。此外,嵌合体问题也是一个重要的顾虑,这无法通过 PGD 来评估,因为我们无法对一个胚胎中的所有细胞进行测序 [17]。这意味着即使被测序的细胞得到了正确的编辑,不可忽视的风险仍然存在——胚胎中的其他细胞可能没有经过编辑,或携带预期外的突变,从而导致无法预测的后果。因此,贺的说法是不可靠的。
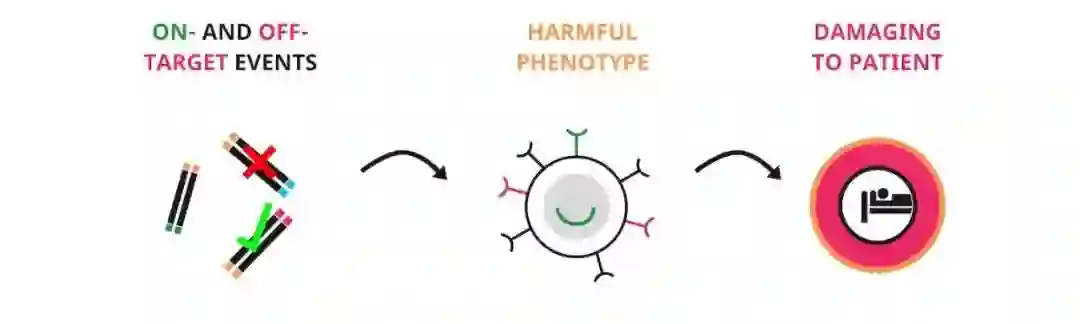
脱靶效应会产生有害后果。图片来源:Gene Editing QC
除了脱靶效应之外,还有研究报告 CRISPR-Cas9 引发的双链断裂可能导致中靶诱变效应(on-target mutagenesis effects)[18,19]。除了不同类型的插入、删除、转位、重排之外,中靶诱变还包括大范围染色体删除、染色体截短、同源基因间修复导致的基因组纯合。目前没有一种单一手段能够检测所有类型的中靶突变,尤其是当它们的发生频率很低的时候。
在两名女婴诞生后,贺的团队从脐带血、脐带和胎盘中采集了 DNA,进行全基因组测序,并宣布 CCR5 编辑成功。全基因组测序结果显示,这些样本中各只存在两种不同的 CCR5 等位基因。分别占测序结果的大约一半。对于露露,一个等位基因保留了野生型,而另一个等位基因出现了非移码删除(in-frame deletion,少了 15 个碱基。译者注:即刚好有 5 个三联密码子被删除,因此其他未被删除的基因所表达的蛋白不会发生改变)。对于娜娜,在全部测序结果中,CCR5 的靶位区域都出现了两个 CCR5 等位基因突变,这表明娜娜的所有样本都没有受到母亲身体组织(其中含有 CCR5 野生型等位基因)的污染,这点实在令人惊异。但是,因为样本采集和数据分析的细节缺失,我们无法得出明确的结论。我们强烈建议相关机构对所有的原始数据进行彻底检查,并对学界和公众披露事实。
总而言之,基于目前所了解的信息,我们确信在科学角度上,没有可靠的理由来对人类生殖细胞进行这种类型的基因编辑,贺建奎及其团队不仅严重违反了中国的法律法规,也违反了国际科研群体所达成的共识。我们在科学和伦理角度对他们极度不负责任的行为提出强烈谴责。我们强烈要求国际科研群体和监管机构尽快发起一场彻底的讨论,为以生殖为目的的人类生殖细胞基因组编辑建立守则和标准。在达成明确共识后,需要在国际水平上通过、建立和执行明确而严格的规定。不过我们同时相信,进一步发展和改进相关技术,在体外实验环境下对人类生殖细胞(包括早期胚胎、精子和卵母细胞)进行精确的基因修饰,是十分必要的。只有对特定疾病的治疗达成共识,并针对性建立指导方针后,这项改进过的技术才有可能被用于应对遗传疾病。

后记
巧合的是,中国科学院科研道德委员会在这篇文章正式发表的前一天下午,就生物医学研究中有悖于伦理规范的常见问题发出“伦理提醒”,倡导在科研实践中恪守各类伦理要求,努力营造风清气正的科研生态(链接)。
正如王皓毅和杨辉在文中所说,只有充分了解其中的科学事实,我们才可能对这一事件进行负责任的审查和讨论,进而建立明确而严格的守则和标准,避免再次出现科学和伦理上的“暴行”。
相关阅读:
贺建奎近况:处于“隔离生活”状态,已被南方科大解除劳动合同关系
广东初步查明“基因编辑婴儿事件”:贺建奎私自开展人类胚胎基因编辑活动
贺建奎公开研究细节并答疑:坚信研究正当性,若患病愿编辑自己的孩子
来自莆田系医院的全球首例基因编辑婴儿:健康与否难说,知情同意存疑
本文来自微信公众号“科研圈”。如需转载,请在“科研圈”后台回复“转载”,或通过公众号菜单与我们取得联系。
▽ 精彩回顾 ▽