哈佛大牛入选“Science十大突破”!最新Nature证实:CRISPR有望“攻克”遗传性耳聋
图片来源:Nature
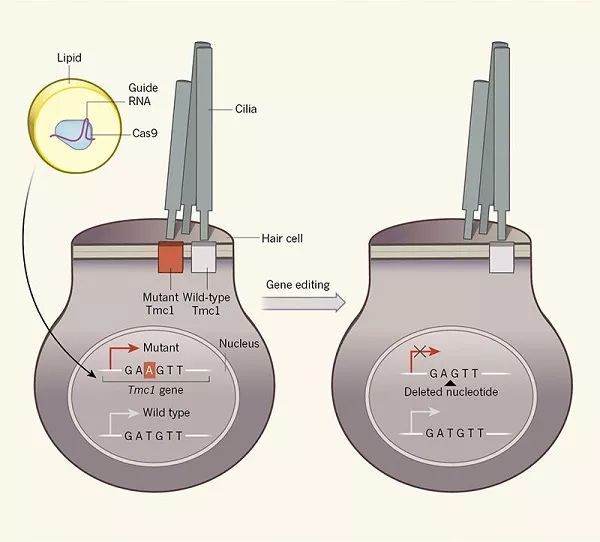
1Tmc1基因
数据显示,几乎一半的耳聋病例都有遗传根源,但治疗耳聋的方法仍是有限的。这是因为,科学家们一直没有研究出能够直接处理“关键问题”(即,破坏听觉的基因突变)的技术。
Tmc1基因突变就是其中的一种。该基因上的单碱基突变(T变成了A)导致了内耳毛细胞随时间的流逝逐渐丧失。具体来说,内耳毛细胞的作用是帮助检测声音:声波会使覆盖在细胞上的毛(bristle)弯曲,犹如风中的麦秆,然后,毛细胞将这种物理信息转化为神经信号,传递到大脑中。
Gene editing in mice can prevent inherited hearing loss. (图片来源:Nature)
无论是在人类还是在小鼠身上,仅仅一个拷贝的突变Tmc1基因就足以导致进行性听力丧失(progressive hearing loss),最终引发耳聋。Liu教授和他的同事推测,如果想办法在小鼠中破坏Tmc1基因的这一突变拷贝,可能会使小鼠保存一些听力。
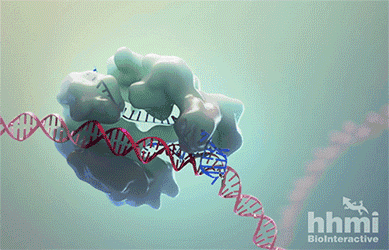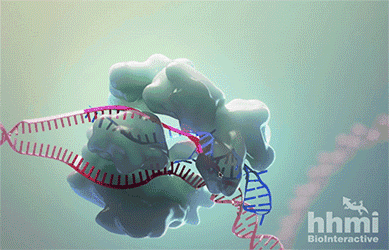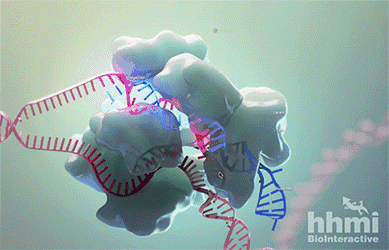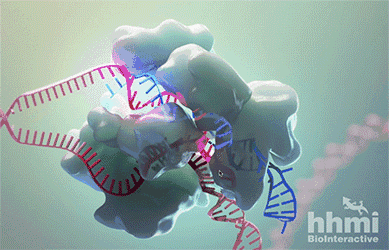
In the genome editing technology known as CRISPR-Cas9, RNA (blue) guides the protein Cas9 (large bumpy structure) to a target site in DNA (red). Cas9 unwinds the DNA double helix and acts as molecular scissors, snipping both strands of DNA.
2克服瓶颈
这几年,迅速成为科研界“新宠”的CRISPR-Cas9技术在这时又“派上了用场”。Cas9酶(上图白色的部分)在这一技术中扮演了“分子剪刀”的角色。它能够在向导RNA(guide RNA)的指引下,与目标DNA序列结合,然后切断双链,最终能够使目标基因失效。
然而,在这一研究中,想让Cas9酶只作用于Tmc1坏的突变拷贝并不容易。因为,Tmc1的突变拷贝和正常拷贝之间只有一个DNA碱基的差别。通常,Cas9酶在作用于目标基因后,它会开始切割其它看起来相似的基因。那么,科学家们是如何克服这一问题的呢?
原来,Liu教授的团队使用了一项他于2015年报道过的技术。他们将Cas9酶和向导RNA装进了油脂包(greasy bundle)中。这种油脂包会在细胞内滑动,从而使得Cas9酶在“破坏”了坏的基因拷贝后“消失”(fade away),而不“误伤”好的基因拷贝。
3喜人结果
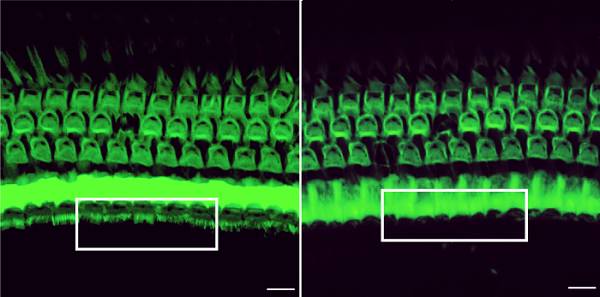
通过与哈佛大学医学院Zheng-Yi Chen团队的合作,研究者们将这一基于CRISPR的工具注射到了携带听力损失突变的幼鼠(infant mice)的一只内耳中(另一耳朵作为对照组)。8周后,经处理的耳朵中的毛细胞变得就像健康小鼠中的毛细胞一样。相比之下,未经治疗的耳朵中的毛细胞仍是损伤的。
Treatment with a genome editing agent can preserve sound-detecting bristles in the inner ear of mice with genetic deafness (white box, left). Without the treatment, these bristles disappear (white box, right). Credit: Gao et al. /Nature 2017
然后,研究人员开始通过监测与听力相关的大脑区域的活性,来测量小鼠内耳的功能。结果显示,与经CRISPR治疗的小鼠相比,研究者们需要更多的声音来刺激未经治疗的小鼠的大脑活性。平均来说,在四周后,经过治疗的耳朵能够比未经处理的耳朵听到约低15分贝的声音。
Liu教授说:“在人类中,这种变化可能会对听力损失患者的生活质量产生重大的影响。”
4业内点评
对于这项新成果,俄勒冈健康与科学大学的感觉生物学家Peter Barr-Gillespie认为,这是一项非常重要的工作。它有力证实了CRISPR技术介导的基因编辑能够导致听力损失的真正改善。
比利时列日大学的神经科学家Brigitte Malgrange也表示:“这是治疗遗传性耳聋一项令人印象深刻的成果。”
但约翰•霍普金斯医学院的神经科学家Ulrich Müller警告称:“这一技术能够在多大程度上适用是一个重要的问题。很多遗传性耳聋在人类胎儿发育早期就表现出来了,这将使这种基因编辑疗法的递送策略更具挑战性。”
David Liu(Credit: Martin Adolfsson)
5点赞大牛
David Liu教授在十多年的时间里,一直在做和CRISPR有关的研究。这两年,因开发出了可用于修复点突变的碱基编辑器(base editors),正越来越受关注。10月底,小编在《哈佛大牛2篇Nature:现在,我们可以自由替换DNA碱基了!》一文中曾详细介绍过相关的成果。今天,这一成果入选了Science评选的“2017年度十大突破”!
Liu教授表示,原则上,碱基编辑器精准的基因编辑能力也可能直接修复与听力损失障碍相关的突变,而不仅仅是破坏突变拷贝。
不过,他也强调,真正在人类中尝试这种疗法之前,科学家们还有很长的路要走。如果未来有一天真的可以用这一方法来治疗人类耳聋,最好在儿童时期开始治疗。因为内耳中毛细胞损失是渐进性的、不可逆转的。这个领域的一个传统看法是,一旦你失去了毛细胞,就很难让它们再回来了。
End
参考资料:1)CRISPR treatment prevents hearing loss in mice
2)CRISPR Helps Mice Hear
3)An ode to gene edits that prevent deafness
4)Gene editing staves off deafness in mice
本文系生物探索原创,欢迎个人转发分享。其他任何媒体、网站如需转载,须在正文前注明来源生物探索。