Nature 子刊:阻止92%的癌细胞扩散!只需使用这种药物!
点击上方“转化医学网”订阅我们!
干货 | 靠谱 | 实用
导 读
肿瘤细胞在机体内的转移定植是肿瘤最终致死的重要原因。目前,世界各国科学家都在围绕肿瘤本身的肿瘤标志物进行深入的研究,在转移定植层面的研究尚浅。Karl Scheidt率领其研究团队利用小分子探针阐明了肿瘤迁移的一种调控机制,并针对此调控机制合成了相应的靶向药物。
到目前为止,该药物在3种实验性的肿瘤模型中获得很好的抗癌效果。该文章发表于6月22日的《Nature Communications》杂志上。
抗癌之路的一大公敌:肿瘤运动及转移
细胞活动的增加是肿瘤细胞的一大特性之一。不断增加的肿瘤运动导致肿瘤细胞从原始肿瘤灶脱离,经血液和淋巴液等途径向全身各个器官组织转移,并在各个器官组织中形成新的转移灶。肿瘤细胞的转移对世界各个领域的肿瘤学者都是一大难题。
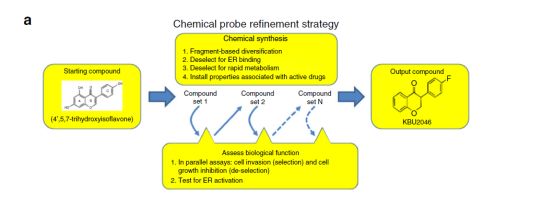
临床上认为,一般出现远处的转移灶就意味着患者错过了手术良机。虽然已经探明了转移相关的部分调控通路,并且也对这些调控通路研发了一些靶向药物。但由于已探明的调控通路大多涉及多条细胞代谢途径,因此药物疗效欠佳。为此,研究人员利用小分子化合物改变其单个原子便可改变整个化合物生化特性的属性,设计和合成了一种新型的生物探针-KBU2046。
阻断细胞迁移运动希望之星- KBU2046
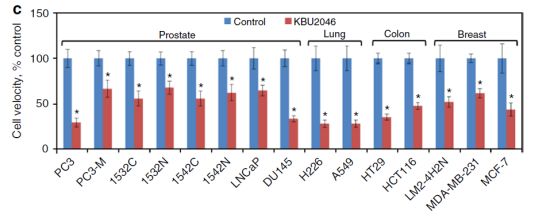
研究人员以4,5,7-三羟基异黄酮为研究起点,通过对其生化功能的不断改进和筛选获得了靶向肿瘤细胞运动的高选择性分子探针KBU2046。同时,研究人员发现KBU2046能够阻断人类前列腺癌,乳腺癌,结肠癌和肺癌细胞的迁移。
细胞层面的分析显示,由于KBU2046的高选择性,其对肿瘤具有高度的靶向作用,因此对其他例如骨髓干细胞等组织细胞并没有毒性。但是,转移是一个系统性的调控机制,因此,研究人员在前列腺癌的小鼠模型中发现该小分子药物以剂量依赖性发挥作用,能够减少92%的转移细胞。同时,KBU2046能够显著延长肿瘤切除术后小鼠的存活时间。
神奇之处:KBU2046与分子伴侣
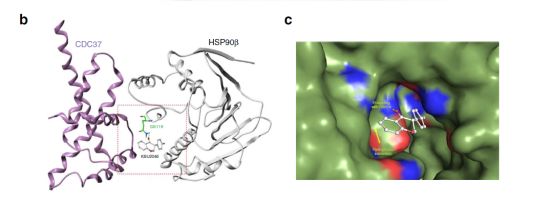
先前的研究表明,热休克蛋白90β(HSP90β)的磷酸化与肿瘤的迁移密切相关。KBU2046能够改变热休克蛋白90β磷酸化过程中的分子状态,进而参与对于肿瘤转移的抑制。但是不同于传统的HSP90β抑制剂,传统的HSP90β抑制剂诱导细胞毒性,并通过与HSP90直接结合,从而抑制其酶活性,继而影响大量细胞激酶和其他蛋白的功能。相反,KBU2046不具有细胞毒性,并且其对蛋白质磷酸化作用具备高度特异性,研究人员猜测其通过改变热休克蛋白内部的分子结构起到抑制作用。
同时研究人员发现KBU2046还可以与HSP90的共分子伴侣CDC37相结合。三者共同组成异质性复合物,进而阻断分子伴侣与其配体蛋白的作用,进而高选择性的阻断肿瘤细胞转移。
这项研究的意义在于为未来的研究提供了一套新的开发平台,同时也设计和合成出了新型的转移阻断药物,虽然对于该药物的研究仍不够充分,但在未来的研究中将会继续阐明其作用机制,同时发现其他抗癌疗效。相信在未来的研究中,研究者可以利用这套技术设计合成出更多高选择性的靶向药物。
参考文献:
Li Xu, Ryan Gordon, Rebecca Farmer, Abhinandan Pattanayak, Andrew Binkowski, Xiaoke Huang. Precision therapeutic targeting of human cancer cell motility
END
转折点——生物医药招聘第一平台