小结
【2019 ASCO进展回顾】绝经前HR+乳腺癌内分泌治疗及研究进展
TEXT/SOFT 联合分析8年随访结果证实,对于绝经前HR+乳腺癌患者,联合卵巢癌功能抑制(OFS)的治疗方案带来了低中高危患者的全线获益。目前,对于中高危患者,国内指南已经常规推荐使用OFS治疗5年。GnRH激动剂(GnRHa)是目前OFS最常用的手段。在刚刚落幕的2019年美国临床肿瘤学会(ASCO)年会上,多项关于OFS用于绝经前HR+早期或晚期乳腺癌的研究报道,梳理相关研究进展如下:
美国2001-2016年绝经前乳腺癌妇女内分泌治疗中OFS的应用
对于绝经前非转移型乳癌患者,临床研究结果提示在内分泌治疗基础上联合卵巢抑制(OFS)可以提高DFS和OS获益。但关于OFS在美国社区癌症中心的使用情况缺乏真实世界数据。研究根据IBM MarketScan的数据库,对2001年至2016年期间确诊的年龄18~50岁乳腺癌妇女进行筛选,纳入在诊断后采用口服内分泌药物治疗的患者。研究将在门诊药房中使用过GnRHa(包括开始内分泌治疗前1周或开始内分泌治疗后,观察时间直至诊断后18个月)的患者定义为OFS使用者。采用线性回归分析,预估每年使用OFS的患者比例,并分析OFS使用于诊断年龄和地域分布的关系。
MarketScan数据库中共26,114女性符合入组标准,其中1,452 (5.6%)患者使用过OFS。最常见使用的OFS药物为亮丙瑞林(55.2%),其次为戈舍瑞林(46.7%)和曲普瑞林(1.1%)。OFS使用比例在2001年的3.2%至2013年的9.3%之间波动,其中2015年使用率最高,达到11.4%。不同地区OFS的使用比例也具有显著差异,其中东北部最高(6.5%),南部最低(5.0%)。年轻患者对比年老患者,使用OFS的比例显著更高,其中诊断年龄每增加1岁,使用比例降低高0.57%(95%CI: -0.63, -0.51)。在校正了年龄组(≤40, 41~44, 45~46, 47~48, 49~50) 和地域分布后,每年OFS使用比例增加0.25%(95% CI: 0.19, 0.31)。
对于50岁以下妇女,美国乳癌内分泌治疗中越来越多采用联用OFS,其中55.2%的OFS药物为亮丙瑞林。
化疗序贯和同步内分泌治疗用于ER阳性乳腺癌辅助治疗
化疗序贯内分泌治疗是ER阳性乳腺癌标准辅助治疗。目前,尚无直接证据证实化疗序贯内分泌的疗效优于联合使用。来自中山大学第一附属医院林颖教授团队进行了一项研究,通过系统评价和贝叶斯网络荟萃分析,对ER阳性乳腺癌辅助治疗中化疗序贯和同步内分泌治疗的疗效进行评价。研究纳入了对比化疗和/或内分泌治疗ER阳性乳腺癌的临床研究。通过贝叶斯分析提取和分析两种治疗方案的DFS和OS HR数据。并根据患者的绝经状态进行亚组分析。
研究共纳入37项临床试验37,225例患者,其中37项临床研究有DFS结果,24项临床研究有OS结果。这些研究对化疗序贯或同步内分泌治疗治疗进行了比较,共3种治疗的药物选择:化疗序贯/同步他莫昔芬;化疗序贯/同步OFS+他莫昔芬;化疗序贯/同步OFS+AI。DFS分析显示,3种治疗选择没有明显统计学差异:化疗序贯/同步他莫昔芬(HR=1.01,95%CI 0.8497~1.199);化疗序贯/同步OFS+他莫昔芬(HR=0.9119,95%CI 0.5666~1.49);化疗序贯/同步OFS+AI(HR=1.032,95%CI 0.6291~1.776)。OS分析也显示出相似的结果,3种治疗选择没有明显统计学差异:化疗序贯/同步他莫昔芬(HR=0.9512,95%CI 0.8053~1.125);化疗序贯/同步OFS+他莫昔芬(HR=1.065,95%CI 0.6344~1.789);化疗序贯/同步OFS+AI(HR=1.069,95%CI 0.665~1.717)。
在此基础上,进一步使用Bayesian算法疗对效无明显统计学差异的不同治疗方式进行相对较优性排名。DFS分析显示,化疗序贯的排名高于同时进行:化疗序贯/同步OFS+AI(1 vs 3);化疗序贯/同步OFS+TAM(6 vs 7);化疗序贯/同步他莫昔芬(8 vs 8)。OS分析中也发现了相似的趋势:化疗序贯/同步OFS+AI(1 vs 2);化疗序贯/同步他莫昔芬(4 vs 5);但化疗序贯/同步OFS+TAM的OS对比上,显示出与DFS相反的趋势(11 vs 6~9)。亚组分析结果显示,在绝经前女性亚组,化疗序贯/同步OFS+AI和化疗序贯/同步OFS+TAM,同步的排名高于序贯。但是在所有亚组中,化疗序贯TAM排名均高于化疗同步TAM。
小结
在ER阳性乳腺癌的辅助治疗中,化疗序贯/同步内分泌治疗显示出相同的疗效;然而,对于绝经前女性,化疗序贯/同步OFS+AI和化疗序贯/同步OFS+TAM方案,同步的排名高于序贯,因此为了这部分患者更好的DFS和OS,推荐同步方案。
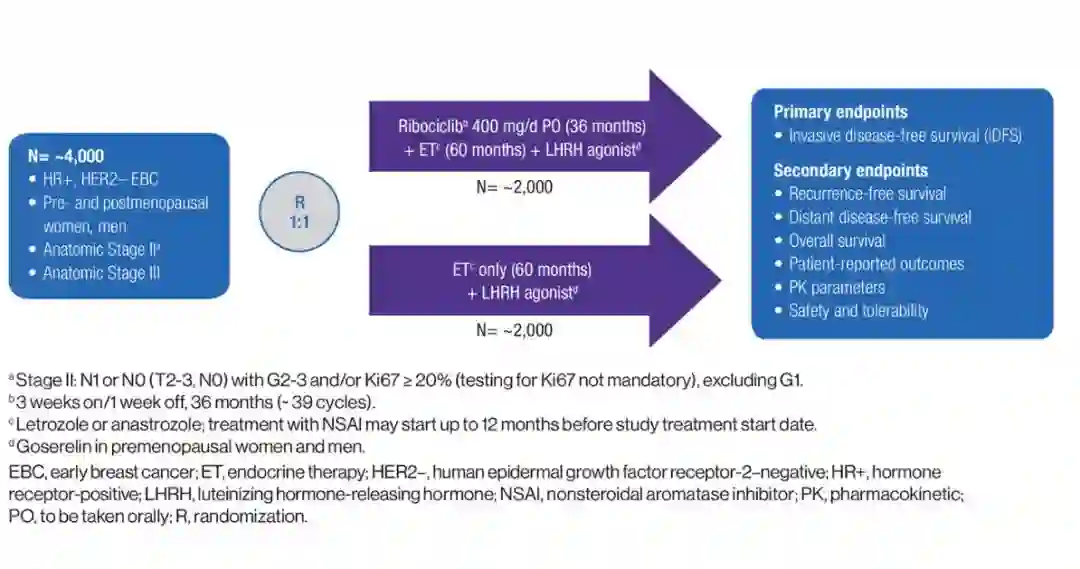
NATALEE研究:Ribociclib+内分泌+GnRHa治疗用于HR阳性HER2阴性早期乳腺癌辅助治疗
这一研究计划入组4000例HR+HER2-早期乳腺癌患者,包括绝经前和绝经后女性或男性,解剖分期为Ⅱ-Ⅲ期。入组患者1:1随机分配接受Ribociclib 400mg/天口服36个月+内分泌治疗60个月+GnRHa或单纯内分泌治疗60个月+GnRHa。主要研究终点为浸润性无病生存(iDFS),次要研究终点包括无复发生存、无远处生存、总生存、患者报告的结局、药代动力学、安全性和耐受性。
NATALEE研究设计
小结
为了提高内分泌治疗的缓解率和延缓耐药,目前HR+HER2-乳癌内分泌联合靶向CDK4/6i治疗已经由晚期解救向早期辅助前推;这一Ⅲ期研究旨在评估Ribociclib联合内分泌及GnRHa用于HR+HER2-早期乳腺癌的疗效和安全性,研究结果将证实在辅助阶段采用CDK4/6抑制剂是否可以提高内分泌治疗疗效,预防和延缓早期乳腺癌获得性耐药。从这一研究设计可知,对于绝经前早期乳腺癌人群,无论单纯内分泌还是将来联合靶向,GnRHa治疗的基石地确证无疑。
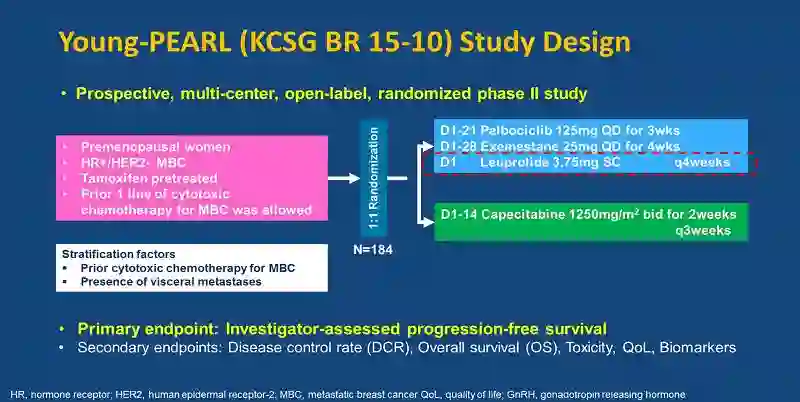
哌柏西利联合依西美坦和亮丙瑞林对比卡培他滨用于绝经前HR+转移性乳腺癌:一项随机Ⅱ期KCSG-BR 15-10研究
KCSG-BR 15-10研究是一项前瞻性、多中心、开放的随机Ⅱ期研究,入组了绝经前HR+HER2-转移性乳腺癌,患者既往接受过他莫昔芬治疗。研究允许既往接受过一线细胞毒化疗的患者入组。184例入组患者按1:1随机分配接受哌柏西利125mg,qd治疗3周+依西美坦25mg,qd治疗4周+亮丙瑞林3.75mg第1天使用,q4w或第1~14天接受卡培他滨1250mg/m2治疗2周,q3w。主要终点为研究者评估的PFS。
KCSG-BR 15-10研究设计
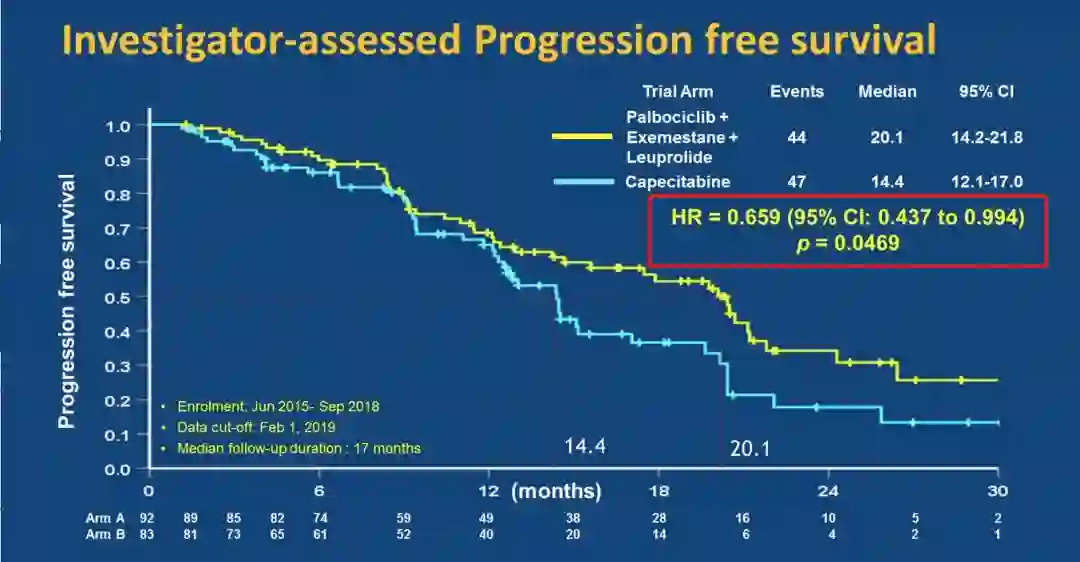
研究达到主要终点,哌柏西利+依西美坦+亮丙瑞林组对比卡培他滨组,可以显著延长PFS,两组的中位PFS分别为20.1个月 vs 14.4个月;HR=0.659(95%CI:0.437~0.994),P=0.0469。亚组分析观察到与总体人群相似的结果。
KCSG-BR 15-10研究PFS结果
小结
本研究是在绝经前HR+HER2-转移性乳腺癌患者中进行的首个CDK4/6i联合AI和OFS对比化疗治疗的研究,且研究人群为东亚人群。结果显示,在东亚绝经前HR+HER2-转移性乳腺癌人群中,哌柏西利+依西美坦+亮丙瑞林相比化疗,可显著延长PFS;该方案可以作为既往接受过他莫昔芬治疗进展后的绝经前ER+/HER2-转移性乳腺癌患者的有效选择。
MONALEESA-7研究OS结果:绝经前HR+HER2-晚期乳腺癌接受内分泌治疗±Ribociclib
MONALEESA-7研究是目前首个在绝经前HR+HER2-晚期乳腺癌患者中评估CDK4/6抑制剂的Ⅲ期研究,研究入组了绝经前/围绝经期HR+HER2-晚期乳腺癌患者,患者既往未接受过内分泌治疗,允许在晚期阶段接受过≤1线治疗。患者随机1:1分配接受Ribociclib 600mg/天,用药3周停药1周+NSAI/TAM+OFS或安慰剂用药3周停药1周+NSAI/TAM+OFS治疗。主要研究终点为PFS,OS为重要次要研究终点。结果显示,Ribociclib+内分泌治疗+OFS vs 安慰剂+内分泌治疗+OFS可以降低29%的死亡风险,两组的中位OS分别为尚未达到和40.9个月,HR=0.712(0.535~0.948),P=0.00973。亚组分析观察到与总体人群相似的结果,其中亚裔/亚洲人群接受CDK4/6抑制剂+ET+OFS的获益更显著。
MONALEESA-7研究OS结果
MONALEESA-7研究亚组分析结果
小结
这是目前首个在绝经前HR+HER2-晚期乳腺癌人群中评估CDK4/6抑制剂+AI/TAM+OFS对比内分泌治疗的OS数据,并观察到CDK4/6抑制剂+ET+OFS相比单纯ET,可显著延长OS,并且在亚裔/亚洲人群获益明显。