Nature重磅:科学家绘制首张小鼠各器官全分子图谱,惊人发现20%-70%成分取决于微生物

众所周知,在我们每一个人的体内和身上,都和谐共生着许许多多的细菌、病毒等微生物。
科学家们已经深知,这些共生的微生物群,深刻地影响着我们机体的健康和疾病发生,菌群生态的失衡也已经被证明与炎症性肠病、免疫系统疾病,甚至认知障碍等宿主的一切生老病死都有着不同程度的关联。
但是,这些共生微生物究竟对宿主各个器官的影响程度如何?以及如此微小的微生物们,究竟如何产生如此巨大的影响呢?
今天,Nature 杂志发表了一项加利福尼亚大学圣地亚哥分校研究人员的重磅成果,他们绘制了有史以来第一张小鼠每个器官中所有分子的图谱,揭示了不同器官被微生物深刻影响的程度和方式。
研究人员通过对比无菌小鼠和具有正常微生物小鼠各个器官的全部分子图谱,结果发现拥有正常共生菌群的小鼠中,多达 70%的肠道化学成分是由其肠道微生物组决定的,即使在一些埋藏得比较「深远」的器官,比如子宫或大脑,也约有 20%的分子是不同的。

论文页面截图(来源:Nature 官网)
「我们经常听到人类基因如何影响我们的健康和行为,因此,当想到我们体内的分子不是由我们自己的基因产生,而是取决于另一种生物,可能会让人感到震惊。」论文通讯作者、加利福尼亚大学圣地亚哥分校斯卡格斯药剂学院和药物科学学院合作质谱创新中心教授兼主任 Pieter Dorrestein 说。
为了比较无菌小鼠和具有正常微生物小鼠的机体「成分」有何不同,研究人员使用了一种称为质谱分析法的实验室技术,来表征每个小鼠器官中的非活性分子,并通过与 GNPS 数据库(由 Dorrestein 和合作者开发的众包质谱资源库)中的参考结构进行比较,来识别尽可能多的分子,他们还通过对作为细菌类型条形码的特定基因区域进行测序,确定了哪些微生物与这些分子共存。
他们总共分析了 4 只无菌小鼠和 4 只正常微生物小鼠 29 个不同器官 96 个部位的 768 个样本,最终绘制出一张含有微生物的正常小鼠体内所有分子的图谱,和一张没有微生物的小鼠体内所有分子的图谱。
对比图谱发现,带有肠道微生物的小鼠中多达 70%的小鼠肠道化学成分是由其肠道微生物组决定的。即使在子宫或大脑中,也约有 20%的分子不同。
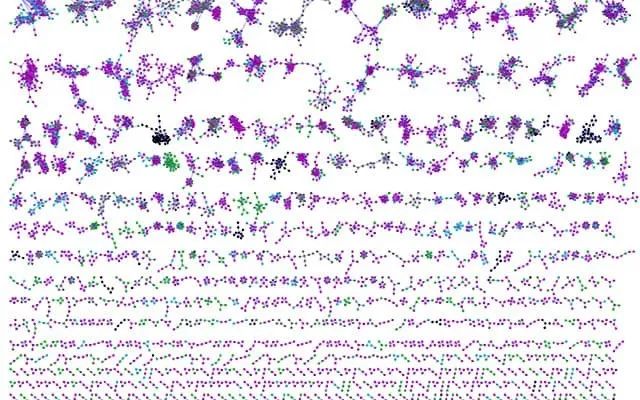
这是此项目中绘制的小鼠器官完整分子图,每个小圆圈代表一个分子,根据化学相似性将它们连接在一起。圆圈的颜色取决于它们是在无菌小鼠中发现的,还是在有微生物的正常小鼠中发现的。粉色代表两者中都发现,绿色代表仅在具有微生物的小鼠中发现,蓝色代表仅在无菌小鼠中发现。图片来源:加利福尼亚大学圣地亚哥分校
研究人员举了一个令人惊讶的例子,他们在具有正常微生物群的小鼠中发现了以前未知结构的胆汁酸,但在无菌小鼠中却没有,这也就意味着,共生微生物的存在能够控制小鼠和人体内胆汁酸的结构。
众所周知,胆汁酸主要是由小鼠或人的肝脏产生,它们有助于消化油脂,同时它们还可以在全身承担传递信息的作用,正常情况下,宿主肝脏中的酶会向胆汁酸中添加氨基酸,特别是甘氨酸和牛磺酸。但是,在微生物群落正常的小鼠中,研究小组发现微生物正在用其他氨基酸(苯丙氨酸,酪氨酸和亮氨酸)标记胆汁酸。
研究人员表示,当改变诸如胆汁酸之类的分子结构时,可能会改变细胞彼此之间的交流方式,以及在给定的时间内「打开」或「关闭」哪些基因,这可能会对身体机能和疾病的发展产生巨大影响。
论文主要作者之一、密歇根州立大学助理教授 Robert Quinn 说:「在过去 170 年的时间里,已经发表了超过 42,000 篇有关胆汁酸的研究论文,然而这一现象却都被忽略了。」
出于对人类体内是否也存在这种经过微生物修饰的胆汁酸的好奇,研究人员使用他们发明的一种工具——质谱探测仪(Mass Spectrometry Search Tool),搜索 1,004 个质谱分析的公共样本数据集。
他们还用质谱分析了提交给美国肠道项目 (American Gut Project) 的大约 3000 份粪便样本。美国肠道项目是加州大学圣地亚哥分校的一个大型公民科学项目。
最终,研究人员发现,在小鼠中观察到的独特微生物修饰的胆汁酸,也存在于数据集中高达 25.3% 的人类样本中。这些新的胆汁酸在婴儿和炎症性肠病或囊性纤维化患者中更为丰富。
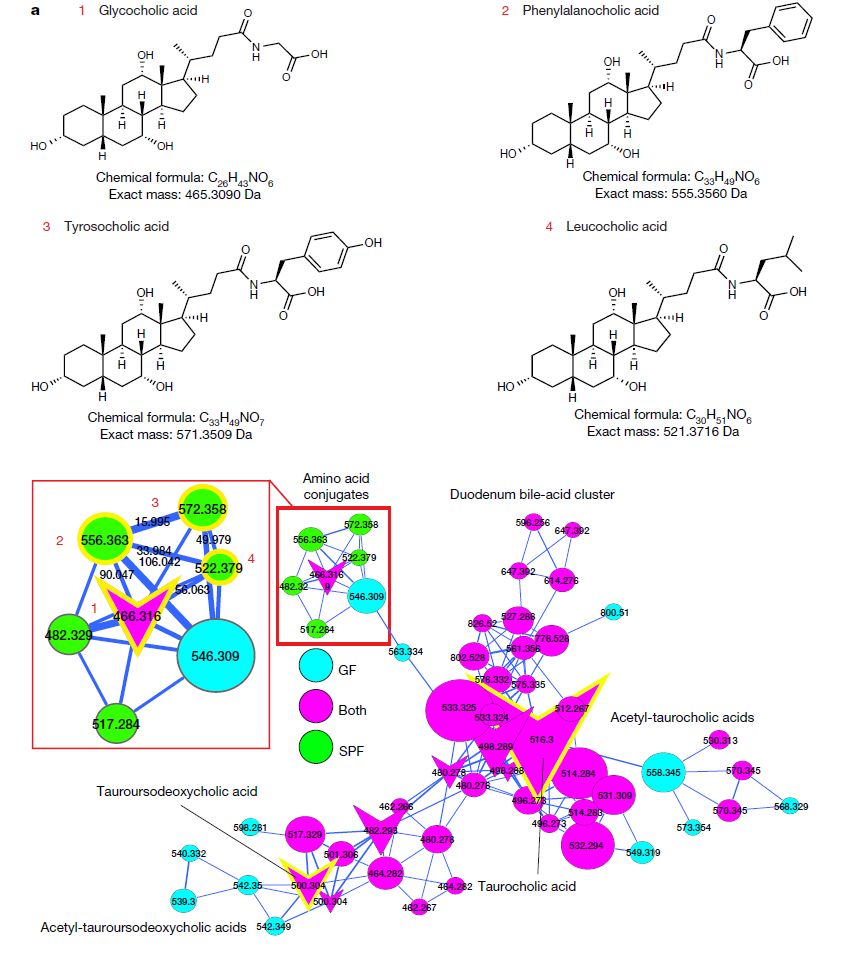
微生物修饰的胆汁酸(来源:Nature)
胆汁酸将信息从肠道传递到身体其他部位的其中一种方式,是通过一种叫做 farnesoid X 的特殊肠道受体。胆汁酸结合并激活受体,然后抑制负责制造更多胆汁酸的基因。受体还有助于调节肝脏中甘油三酯的水平和肠道中的体液调节,使它们在肝病和肥胖中发挥重要作用。目前正在开发的几种肝脏疾病药物,也正是通过激活 farnesoid X 受体来实现治疗。
为了进一步验证其发现,研究人员在实验室中生长的小鼠和人类细胞中,也发现了微生物修饰的胆汁酸能够强烈刺激 farnesoid X 受体,从而降低肝脏中产生胆汁酸相关基因的表达。
研究人员认为,该研究提出了许多关于微生物可能在驱动肝脏等其他疾病,以及在影响药物活性方面所起作用的问题,例如针对 farnesoid X 受体的药物。
Dorrestein 表示:「这项研究为微生物如何影响人类基因的表达提供了一个明确的证据。但目前我们仍然不知道这可能产生的后果,或者我们如何能够干预以改善人类健康。」
在人的身体内,居住着数以万亿计的细菌和其他微生物,分别寄生在人们的皮肤、生殖器、口腔,特别是肠道等部位。据估计,人体肠道内的微生物数量大约 100 万亿个,超过自身细胞总量的 10 倍以上,因此肠道微生物也被称为人体的「第二基因组」。
作为人体最庞大、最复杂的微生态系统,肠道微生物本身及其代谢产物不仅能调节人体健康,更在膳食和宿主之间起到了重要的桥梁作用。正如诺贝尔奖获得者 Joshua Lederberg 曾指出的,人体与人体共生微生物构成了超级生物体(superorganism)。
随着基因测序技术的不断成熟,人们人体内存在的微生物研究越来越多,比如美国国立卫生研究院开展为期5年的人类微生物组计划,欧盟人类宏基因组第七框架项目的子项目,人类肠道宏基因组计划等,这一系列的系统研究正在揭示人体微生物神秘的面纱。
作为人体的第二基因组,科学家们已经发现了人体微生物与人类健康的密切关系,例如,人体微生物的研究发现肠道菌群结构的改变与失衡除了会导致肠道疾病外,还与糖尿病、肥胖等很 多慢性全身性代谢性疾病有密切关系,甚至还与癌症有关。
如今,随着研究的不断深入,科学家们已经意识到了人体微生物对人类存在着至关重要的作用,同时,越来越多的发现也让科学家们意识到该领域还有太多的未知。人类与共生微生物之间的秘密,就如同一个科学宝藏,等待着更多科学家们一点一点挖掘。
Nature论文原文链接:
https://nature.com/articles/s41586-020-2047-9
参考资料:
https://www.eurekalert.org/emb_releases/2020-02/uoc--hrm022420.php