【最新】2018年版前列腺癌诊疗规范(附:原文下载)
世界范围内,前列腺癌发病率在男性所有恶性肿瘤中位居第二。在美国前列腺癌的发病率已经超过肺癌,成为第一位危害男性健康的肿瘤。亚洲前列腺癌的发病率远远低于欧美国家,但近年来呈现上升趋势,且增长比欧美发达国家更为迅速。文末下载原文!
前列腺癌诊疗规范(2018年版)
一、概述
世界范围内,前列腺癌发病率在男性所有恶性肿瘤中位居第二。在美国前列腺癌的发病率已经超过肺癌,成为第一位危害男性健康的肿瘤。亚洲前列腺癌的发病率远远低于欧美国家,但近年来呈现上升趋势,且增长比欧美发达国家更为迅速。根据国家癌症中心的数据,前列腺癌自2008年起成为男性泌尿系统中发病率最高的肿瘤,2014年的发病率达到9.8/10万,在男性恶性肿瘤发病率排名中排第6位;死亡率达到4.22/10万,在所有男性恶性肿瘤中排第9位。值得注意的是我国前列腺癌发病率在城乡之间存在较大差异,特别是大城市的发病率更高。2014年前列腺癌城市和农村的发病率分别为13.57/10万和5.35/10万。
从发病年龄来看,我国城市地区自60岁开始出现前列腺癌的发病高峰,而在美国高峰年龄段由50岁开始。上海市男性前列腺癌发病率在65岁以后显著高于香港和台湾地区。由于人均寿命的延长,目前上海市65岁以上人口已经占总人口的10%以上,可以预见前列腺癌的绝对发病数将出现井喷性增长。
此外,我国前列腺癌患者的分期构成与西方发达国家存在着巨大差别。以美国的情况为例,在其确诊的新发前列腺癌病例中,接近91%的患者为临床局限型前列腺癌,这些患者的一线治疗为根治性手术或根治性放疗,在接受标准治疗后预后较好,5 年生存率接近100%。而我国的新发病例中在确诊时仅30%为临床局限型患者,余者均为局部晚期或广泛转移的患者,这些患者无法接受局部的根治性治疗,预后较差。
二、危险因素
前列腺癌的病因及发病机制十分复杂,其确切病因尚不明确,病因学研究显示前列腺癌与遗传、年龄、外源性因素如环境因素、饮食习惯等有密切关系。
(一)遗传因素及年龄
前列腺癌的发病率在不同种族间有巨大的差别,黑人发病率最高,其次是白种人,亚洲人种发病率最低,提示遗传因素是前列腺癌发病的最重要因素之一。流行病学研究显示:一位直系亲属(兄弟或父亲)患有前列腺癌,其本人患前列腺癌的风险会增加1倍以上;2个或2个以上直系亲属患前列腺癌,相对风险会增至5~11倍,有前列腺癌家族史的患者比无家族史的患者确诊年龄约早6~7年。约9%前列腺癌患者为真正家族遗传型前列腺癌,家族遗传型前列腺癌是指3个或3个以上亲属患病或至少2个为早期发病,患者发病时年龄年轻,43%的患者年龄≤55岁。
前列腺癌的发病与年龄密切相关,其发病率随年龄而增长,年龄越大发病率越高,高发年龄为65~80岁。
(二)外源性因素
流行病学资料显示亚洲裔人群移居美国后前列腺癌发病率会明显升高,提示地理环境及饮食习惯等外源性因素也影响前列腺癌的发病。
目前,有关前列腺癌的外源性危险因素仍在研究中,部分因素仍在争议。酒精摄入量过多是前列腺癌的高危因素,同时与前列腺特异性死亡率相关。过低或者过高的维生素D水平和前列腺癌的发病率有关,尤其是高级别前列腺癌。阳光暴露能适当增加维生素D的水平,可以降低前列腺癌的患病风险。油炸食品的摄入与前列腺癌的发病相关。在前列腺癌低发的亚洲地区,绿茶的饮用量相对较高,流行病学资料显示绿茶可能是前列腺癌的预防措施之一。荟萃分析显示胡萝卜素有降低前列腺癌发生率的趋势,然而随机对照临床研究并未得出上述结论。研究发现维生素E和硒并不能影响前列腺癌的发病率。对于性腺功能减退的患者,补充雄激素并未增加前列腺癌的患病风险。
三、病理分类及分级系统
前列腺癌主要好发于前列腺外周带,约占70%,15%~25%起源于移行带,其余5%~10%起源于中央带,其中85%前列腺癌呈多灶性生长特点。2016年WHO出版的《泌尿系统及男性生殖器官肿瘤病理学和遗传学》中,前列腺癌病理类型包括腺癌(腺泡腺癌)、导管内癌、导管腺癌、尿路上皮癌、鳞状细胞癌、基底细胞癌以及神经内分泌肿瘤等等。其中前列腺腺癌占主要部分,因此通常我们所说的前列腺癌是指前列腺腺癌。
前列腺腺癌的病理分级推荐使用Gleason评分系统。该评分系统把前列腺癌组织分为主要分级区和次要分级区,每区按5级评分,主要分级区和次要分级区的Gleason分级值相加得到总评分即为其分化程度。
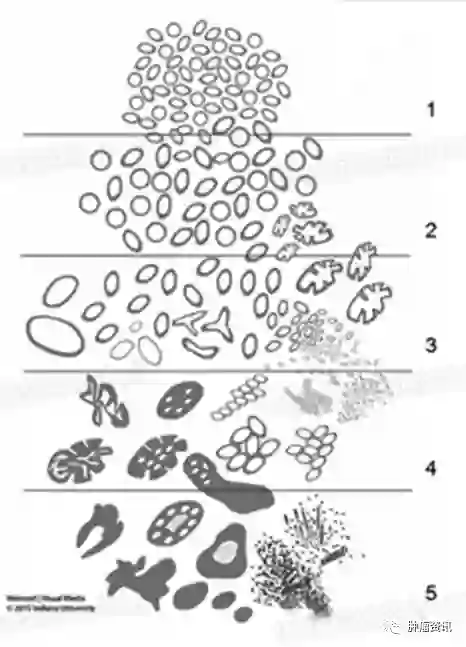
Gleason评分系统是目前世界范围内应用最广泛的前列腺腺癌的分级方法,自2004版发布以来经历了几次修改,新版WHO分类中对其进行了详细介绍(图1),具体如下:Gleason 1级是由密集排列但相互分离的腺体构成境界清楚的肿瘤结节;Gleason 2级肿瘤结节有向周围正常组织的微浸润,且腺体排列疏松,异型性大于1级;Gleason 3级的肿瘤性腺体大小不等,形态不规则,明显地浸润性生长,但每个腺体均独立不融合,有清楚的管腔;Gleason 4级肿瘤性腺体相互融合,形成筛孔状,或细胞环形排列中间无腺腔形成;Gleason 5级呈低分化癌表现,不形成明显的腺管,排列成实性细胞巢或单排及双排的细胞条索。
图1 Gleason评分系统
Gleason评分还需遵守以下原则:①Gleason评分2~5分不适用于穿刺活检标本诊断中,且在其他方式切除标本中也应慎用;②筛状腺体归为Gleason 4级;③肾小球样结构的腺体应为Gleason 4级;④黏液腺癌的分级应根据其生长方式进行判断,而不是均归为Gleason 4级;⑤Gleason 4级除包括筛状结构和肾小球样结构外,一些分化较差的腺体和融合的腺体也应归为Gleason 4级;⑥出现粉刺样坏死即可为Gleason 5级;⑦导管腺癌中的筛状和乳头状为Gleason 4级,PIN样导管腺癌则归入Gleason 3级,伴有坏死者为Gleason 5级;⑧在高级别腺癌中,如果低级别成分<5%可以被忽视。相反,在穿刺活检标本中,若有高级别成分存在,无论其比例多少,均应计入评分。⑨在根治标本中,如按之前标准在Gleason评分为7分(4+3)的组织中发现>5%的Gleason 5级的成分,最终评分应为Gleason 9分(4+5);仅出现少量5级成分时,报第三位评分为5级;⑩经治后的肿瘤形态改变明显,可以不评分。
新版WHO提出的前列腺癌新的分级分组是基于2014年国际泌尿病理协会(ISUP)共识会议上提出的一种新的分级系统,并称之为前列腺癌分级分组(Grading Groups)系统,该系统根据Gleason总评分和疾病危险度的不同将前列腺癌分为5个不同的组别:
1.分级分组 1 级:Gleason 评分 ≤ 6,仅由单个分离的、形态完好的腺体组成。
2.分级分组 2 级:Gleason 评分 3+4=7,主要由形态完好的腺体组成,伴有较少的形态发育不良腺体 / 融合腺体 / 筛状腺体组成。
3.分级分组3级:Gleason 评分 4+3=7,主要由发育不良的腺体 / 融合腺体 / 筛状腺体组成,伴少量形态完好的腺体。
4.分级分组4级:Gleason 评分 4+4=8 ;3+5=8 ;5+3=8,仅由发育不良的腺体 / 融合腺体 / 筛状腺体组成 ;或者以形态完好的腺体为主伴少量缺乏腺体分化的成分组成;或者以缺少腺体分化的成分为主伴少量形态完好的腺体组成。
5.分级分组5级:Gleason 评分 9-10,缺乏腺体形成结构(或伴坏死),伴或不伴腺体形态发育不良或融合腺体或筛状腺体。
前列腺癌分期系统目前最广泛采用的是美国癌症分期联合委员会(American Joint Committee on Cancer Staging,AJCC)制订的TNM分期系统,采用2017年第8版。
表 1.前列腺癌 TNM 分级系统
原发性肿瘤 (T)
临床
TX 原发肿瘤无法评估
T0 没有原发肿瘤证据
T1 不能被扪及和影像无法发现的临床隐匿性肿瘤
T1a 在 5% 或更少的切除组织中偶然的肿瘤病理发现
T1b 在 5 % 以上的切除组织中偶然的肿瘤病理发现
T1c 穿刺活检证实的肿瘤(如由于 PSA 升高),累及单侧或者双侧叶,但不可扪及
T2 肿瘤可扪及,局限于前列腺之内
T2a 肿瘤限于单侧叶的二分之一或更少
T2b 肿瘤侵犯超过单侧叶的二分之一,但仅限于一叶
T2c 肿瘤侵犯两叶
T3 肿瘤侵犯包膜外,但未固定也未侵犯临近结构
T3a 包膜外侵犯(单侧或双侧)
T3b 肿瘤侵犯精囊(单侧或双侧)
T4 肿瘤固定或侵犯除精囊外的其他邻近组织结构:如外括约肌、直肠、膀胱、肛提肌和 / 或盆壁。
病理 (pT)*
pT2 局限于器官内
pT3 前列腺包膜外受侵
pT3a 前列腺受侵(单侧或者双侧),或显微镜下可见侵及膀胱颈
pT3b 侵犯精囊
pT4 肿瘤固定或侵犯除精囊外的其他邻近组织结构:如外括约肌、直肠、膀胱、肛提肌和 / 或盆壁。
* 注 : 没有病理学 T1 分类。
** 注 : 切缘阳性,由 R1 表示,提示可能存在显微镜下残余病灶。
区域淋巴结 (N)
临床
NX 区域淋巴结无法评估
N0 无区域淋巴结转移
N1 区域淋巴结转移
远处转移 (M)*
M0 无远处转移
M1 远处转移
M1a 非区域淋巴结的转移
M1b 骨转移
M1c 其他部位转移,有或无骨转移
* 注 : 如果存在一处以上的转移,则按最晚期分类 pMIc 为最晚期。
风险分组
1) 极低危:T1c,Gleason 评分 ≤ 6/分级分组1级,PSA <10 ng/ml,前列腺活检阳性针数少于 3 个,每针癌灶≤ 50%,PSA 密度 <0.15 ng/ml/g。
2) 低危:T1-T2a,Gleason 评分 ≤ 6/分级分组1级,PSA <10 ng/ml
3) 中危偏好:T2b-T2c,或Gleason 评分 3+4=7/分级分组2级,或PSA 10-20 ng/ml但是前列腺活检阳性针数少于50%。
4) 中危偏差:T2b-T2c,或Gleason 评分 3+4=7/分级分组2级,或Gleason 评分 4+3=7/分级分组3级,或PSA 10-20 ng/ml。
5) 高危:T3a 或Gleason 评分8/分级分组4级,或Gleason 评分9-10/分级分组5级,或PSA >20 ng/ml。
6) 极高危:T3b-T4,或分级分组5级,或穿刺活检有 4针以上 Gleason评分 8-10/分级分组4级或5级。
四、诊断评价
(一)高危人群的监测筛查
前列腺癌的筛查在欧美国家曾经广泛开展。比如美国前列腺癌的死亡率在近些年有所下降,部分原因应归功于广泛严格的前列腺癌筛查政策。当然,随着越来越多的晚期前列腺癌被发现并治疗后,早期前列腺癌的比例越来越高,可能存在少部分过度诊断以及过度诊疗的问题。因此目前在欧美国家有关基于全体人群的前列腺癌筛查也存在很大的争议。然而在我国,由于未曾开始过大规模的前列腺癌筛查,人群中应该有相当数量的高侵袭性或晚期前列腺癌病例,因此在我国现阶段,开展前列腺癌筛查是非常有必要的。推荐对于50岁以上,或者是有前列腺癌家族史的45岁以上男性,在充分告知筛查风险的前提下,进行以PSA检测为基础的前列腺癌筛查。
PSA是前列腺腺泡和导管上皮细胞合成分泌的一种具有丝氨酸蛋白酶活性的单链糖蛋白,主要存在于精液中,参与精液的液化过程。正常生理条件下,PSA主要局限于前列腺组织中,血清中PSA维持在低浓度水平。血清中PSA有两种存在形式,一部分(10%~40%)为游离PSA(f-PSA);一部分(60%~90%)以α1-抗糜蛋白酶(PSA-ACT)、少量与α-2-巨球蛋白等结合,称为结合PSA(c-PSA)。通常以f-PSA与结合PSA的总和称为血清总PSA(t-PSA)。当前列腺发生癌变时,正常组织破坏后,大量PSA进入血液循环使血清中PSA升高。PSA半衰期为2~3天。
PSA结果的判定:血清总PSA(tPSA)>4.0ng/ml为异常,初次PSA异常者需要复查。患者血清PSA水平受年龄和前列腺大小等因素的影响。
血清总PSA在4ng/ml-10ng/ml时,fPSA具有一定的辅助诊断价值。因为患者外周血fPSA水平与前列腺癌的发生呈负相关,当fPSA/tPSA<0.1,患前列腺癌的概率为56%,而当 fPSA/tPSA>0.25,其概率仅为8%。因此我国推荐fPSA/tPSA>0.16作为正常参考值。若患者tPSA水平在4ng/m-10ng/ml,而fPSA/tPSA<0.16应建议进行前列腺穿刺活检。
此外,通过超声或者其他方法测定前列腺体积,再计算PSA密度(PSAD),PSAD越大,具有临床意义的前列腺癌的可能性越大。此外,也可以通过时间计算出PSA速度(PSAV)以及PSA倍增时间(PSADT),然而这两项指标对于判断预后具有一定的作用,在诊断开始阶段,由于干扰因素较多,意义相对较小。
由于PSA的肿瘤特异性不高,学者们一直在寻找新的前列腺癌特异性肿瘤标志物。近年来,PSA同源异构体 2(p2PSA)及其衍生物,以及前列腺健康指数(PHI)等评价指标逐渐受到关注。 研究结果表明,p2PSA与前列腺癌和高分级前列腺癌相关,特别是对于tPSA 为4~10ng/ml的人群而言,PHI诊断前列腺癌的效力优于tPSA,可以减少不必要的前列腺穿刺活检。通过tPSA、fPSA和p2PSA 计算PHI,公式如下:
PHI = p2PSA / fPSA ×
前列腺特异性膜抗原(prostrate specific mem-brane antigen,PSMA):PSMA是一种膜结合糖蛋白,对前列腺良性和恶性上皮细胞均有很高的特异度。正常男性的血清可以检测到PSMA,而前列腺癌患者的PSMA值较高。PSMA值与高分期病变或雄激素非依赖状态有一定的相关性。
长链非编码RNA前列腺癌抗原3(prostate cancer antigen 3,PCA3):PCA3是一种在前列腺癌中表达的因子。已被美国FDA批准作为诊断前列腺癌的标志物。在PSA升高的患者中,使用PCA3作为诊断标志物比使用tPSA、fPSA等更能提高前列腺癌的诊断准确率。EAU指南推荐在初始前列腺穿刺阴性,但仍怀疑前列腺癌的患者中进行PCA3检测。
(二)基因检测
转移性或局限性高危或低至中危前列腺癌男性患者DNA 修复基因突变的总体发病率分别为11.8%、6%和 2%。对 DNA 修复基因突变频率的新认识,对于家族遗传咨询以及更好评估个体继发性癌症风险具有重要意义。转移性去势抵抗性前列腺癌(CRPC)患者中,DNA 修复基因突变频率可能更高(高达 25%)。早期研究表明,这种突变可能预示着多聚ADP核糖聚合酶(PARP)抑制剂的临床益处。特别是初步数据表明,PARP抑制剂奥拉帕尼对这些患者有效。据报道,DNA修复缺陷可预示肿瘤对铂剂的敏感度。
专家组建议询问家庭和个人的癌症史,如果怀疑有家族性癌症综合征,则推荐遗传咨询会诊。此外,由于种系突变的高发病率,专家组建议对转移性和高危/极高危的临床局限性前列腺癌患者考虑进行种系检测,该检测前后的遗传咨询至关重要。
数据还表明,有 BRCA1/2 种系突变的前列腺癌患者局部治疗进展的风险增加、OS降低。如果考虑对这些患者进行主动监测,应该与其讨论这些信息。
(三)直肠指诊(DRE)
前列腺癌多发生于前列腺外周带,DRE对前列腺癌的早期诊断和分期具有重要参考价值。前列腺癌的典型表现是可触及前列腺坚硬结节,边界欠清,无压痛。若未触及前列腺结节也不能排除前列腺癌,需要结合PSA及影像学检查等综合考虑。DRE挤压前列腺可导致PSA入血,影响血清PSA值的准确度,因此DRE应在患者PSA抽血化验后进行。
(四)前列腺磁共振检查(MRI/MRS)
MRI检查是诊断前列腺癌及明确临床分期的最主要方法之一。主要依靠T2加权像和强化特征,前列腺癌的特征性表现是前列腺外周带T2加权像中有低信号病变,与正常高信号的外周带有明显差异;另外,肿瘤区域往往呈现早期强化的特点。前列腺MRI可显示前列腺癌外周包膜的完整性、是否侵犯前列腺周围脂肪组织、膀胱及精囊器官;预测包膜或包膜外侵犯的准确率达70%~90%,预测有无精囊受侵犯的准确率达90%;MRI可显示盆腔淋巴结受侵犯情况及骨转移的病灶,对前列腺癌的临床分期具有重要的作用。
过去几年里,多参数 MRI (mpMRI)在分期和前列腺癌表征中的使用有所增加。要被认为是“多参数”,MRI 影像就必须是包括T2 加权像以外至少一个序列所取得的影像,如弥散加权成像(DWI)或动态增强(DCE)。此外,高质量 mpMRI 需要 3.0 T 磁体;是否需要直肠内线圈仍存在争议。
在前列腺癌诊断和治疗的不同阶段都可以应用 mpMRI。首先,mpMRI 有助于检测较大的低分化癌(即 Gleason 评分 ≥ 7/Gleason 分级分组 2 级及以上)。mpMRI 已被纳入磁共振-超声(MRI-TRUS)融合靶向活检方案,这种方案实现了用更少的活检针数穿刺诊断出更多高级别癌,同时减少检出低级别和临床无意义癌。其次,mpMRI在包膜外是否受侵(T 分期)等方面提供帮助,在低风险患者中有较高的阴性预测值,结果可为保留性神经手术方面的决策提供信息。再次,mpMRI 在盆腔淋巴结评估方面与 CT 相当。最后,对于骨转移的检测,mpMRI 优于骨扫描和CT,具有 98%~100% 的灵敏度和 98%~100% 的特异度。
磁共振波谱成像 (magnetic resonance spectroscopy,MRS)是根据前列腺癌组织中枸橼酸盐、胆碱和肌酐的代谢与前列腺增生、正常组织中的差异呈现出不同的光谱线来反映机体内细胞的代谢变化,可弥补常规MRI的不足,对前列腺癌的早期诊断也具有一定的参考价值。
(五)骨扫描检查
骨扫描是目前评价前列腺癌骨转移最常用的方法。荟萃分析显示骨扫描的敏感度和特异度分别为79%和82%。骨扫描的诊断的阳性率受PSA、临床分期以及Gleason评分的影响很大,在PSA < 10 ng/ml的患者中阳性率2.3%,PSA 10~20ng/ml,阳性率为5.3%,PSA 20~50 ng/ml阳性率为16.2%。局限性前列腺癌阳性率为6.4%,局部晚期前列腺的阳性率为49.5%。Gleason 评分 7分患者的阳性率为5.6%,而Gleason 评分 8分及以上患者的阳性率为29.9%。当有骨痛症状时,无论PSA、Gleason评分以及临床分期何种情况,都要进行骨扫描检查。
(六)PET-CT的应用
C-11 胆碱 PET-CT 已被用于检测和区分前列腺癌和良性组织。这项技术在生化复发再分期患者中的灵敏度和特异度分别为 85% 和 88%。 C-11 胆碱 PET-CT 可能有助于检测这些患者中的远处转移。
前列腺特异性膜抗原(PSMA)在前列腺癌细胞表面特异性高表达,使其在前列腺癌分子影像学及靶向治疗领域具有极为重要的研究价值,特别是核素标记PSMA小分子抑制剂已在前列腺癌的分子影像学诊断方面显示出较好的临床应用前景。68Ga-PSMA PET-CT 显像对前列腺癌患者诊断的灵敏度为86%,特异度为86%;针对前列腺癌病灶的灵敏度为80%,特异度为97%。68Ga-PSMA PET-CT 对前列腺癌的诊断准确度远高于传统影像学检查,如磁共振、CT及前列腺超声。
(七)前列腺穿刺活检
1.前列腺初次穿刺指征和禁忌证
前列腺穿刺指征包括:①直肠指诊发现前列腺可疑结节,任何PSA值;②经直肠前列腺超声或MRI发现可疑病灶,任何PSA值;③PSA>10 ng/ml;④PSA 4~10ng/ml,f/t PSA可疑或PSAD值可疑。
前列腺穿刺的禁忌证包括:①处于急性感染期、发热期;②有高血压危象;③处于心脏功能不全失代偿期;④有严重出血倾向的疾病;⑤处于糖尿病血糖不稳定期;⑥有严重的内、外痔,肛周或直肠病变。
2.前列腺穿刺活检术的实施
1)穿刺术前常规检查:因前列腺穿刺活检术会引起前列腺局部MRI影像的改变,故如需通过MRI评估临床分期,通常建议在前列腺穿刺活检前进行。
2)预防性抗菌药物的应用:经直肠超声引导下前列腺穿刺活检术之前,应常规口服或静脉预防性应用抗菌药物,喹诺酮类抗菌药物是首选,经会阴前列腺穿刺前不需要预防性应用抗菌药物。
3)肠道准备:经直肠前列腺穿刺活检前清洁肠道是常规操作,开塞露可代替灌肠,建议穿刺前碘伏清洁肠道。
4)围手术期抗凝及抗血小板药物的使用:对于有心脑血管病风险、支架植入病史的长期口服抗凝或抗血小板药物的患者,围手术期应综合评估出血风险及心脑血管疾病风险,慎重决定相关药物的使用。
5)穿刺针数和部位:建议前列腺体积为30~40 ml的患者,需接受不少于8针的穿刺活检,推荐10~12针系统穿刺作为基线(初次)前列腺穿刺策略。穿刺针数的增加不显著增加并发症的发生率。饱和穿刺可作为一种穿刺策略。
3.重复穿刺
当第1次前列腺穿刺结果为阴性,但DRE、复查PSA或其他衍生物水平提示可疑前列腺癌时,可考虑再次行前列腺穿刺。如具有以下情况需要重复穿刺:①首次穿刺病理发现非典型性增生或高级别PIN,尤其是多针病理结果如上;②复查PSA>10 ng/ml;③复查PSA 4~10 ng/ml 、%fPSA、PSAD值、DRE或影像学表现异常,如TRUS或MRI检查提示可疑癌灶,可在影像融合技术下行兴趣点的靶向穿刺;④PSA 4~10 ng/ml,%fPSA、PSAD值、DRE、影像学表现均正常的情况下,每3个月复查PSA。如PSA连续2次>10 ng/ml,或PSA速率(PSAV)>0.75 ng/ml,需要重复穿刺。
重复穿刺前除常规检查外,推荐行多参数MRI检查,基于多参数MRI的靶向穿刺可显著提高重复穿刺阳性率并避免漏诊高危前列腺癌。关于重复穿刺的时机,两次穿刺间隔时间尚有争议,建议3个月或更长,待组织结构完全恢复。
重复穿刺前如影像学发现可疑灶,应对可疑灶行靶向穿刺。
4.前列腺系统穿刺的局限性及新策略
经直肠或经会阴前列腺系统穿刺活检术的主要局限在于假阴性、漏诊高危前列腺癌和过度诊断。如何在提高穿刺阳性率的同时避免过度诊断是前列腺癌早期诊断中面临的巨大挑战。近年来,以超声增强造影、超声弹性成像和多参数MRI为靶向的前列腺穿刺活检术在发现有临床意义前列腺癌、避免过度诊断方面展现了明显的优势。
MRI引导的靶向穿刺可在MRI引导下直接对可疑灶进行取材,其精确性最高。已有多项研究显示,MRI引导前列腺穿刺活检可以提高重复穿刺时高级别前列腺癌的检出率。但操作相对复杂,且价格昂贵,有一定推广难度。
MRI/TRUS融合技术结合了MRI定位的精度与经直肠超声引导穿刺的便利,在显著提高穿刺阳性率的同时,能够增加发现有临床意义的前列腺癌的比例并避免发现无临床意义的前列腺癌,与MRI下的穿刺相比操作更加便利。
五、前列腺癌的治疗
(一)观察等待(watchful waiting)与主动监测(active surveillance)
观察等待包括前列腺癌病程监测,以期在症状出现、检查结果改变或 PSA 提示即将出现症状时能及时提供姑息治疗。因此,观察不同于主动监测。观察的目的是在前列腺癌不太可能导致死亡或显著发病时,通过避免非治愈性治疗保持患者的生活质量。观察的主要优势是避免不必要的治疗(如 ADT)可能引起的不良反应。一般适用于预期寿命小于10年的各期患者。
主动监测包括对疾病进程的主动动态监测,以期在发现肿瘤进展时能及时采取以根治为目的的干预措施,主要适用于预期寿命10年以上的低危前列腺癌患者,目的是在不影响总生存期的前提下,推迟可能的治愈性治疗从而减少治疗可能引起的副作用。由于这类患者有着更长的预期寿命,因此应当对他们进行密切随访,包括DRE、PSA、mpMRI以及重复穿刺等,一旦发现肿瘤进展,应立即开始治疗以免错过治愈机会。
主动监测的患者入选标准包括:预期寿命10年以上,肿瘤分期cT1或cT2,PSA ≤ 10 ng/ml,活检Gleason评分≤6,阳性针数≤2个,每个穿刺标本中肿瘤所占比例≤50%。对这类患者实施主动监测前,要与患者充分沟通根治性手术和根治性放疗的情况,告知患者在未来的某个阶段可能要接受根治性的手术或者放疗。随访过程中要进行DRE(至少每年1次)、PSA(至少每半年1次)、mpMRI以及重复穿刺(至少每3-5年1次)等检查。
当重复活检后的病理发生变化时,如Gleason评分、阳性针数或者肿瘤所占体积,以及T分期进展,则应将主动监测调整为积极治疗。
(二)根治性前列腺切除术
根治性前列腺切除术的目的是彻底清除肿瘤,同时保留控尿功能,尽可能地保留勃起功能。手术可以采用开放、腹腔镜以及机器人辅助腹腔镜等方式。机器人辅助腹腔镜根治性前列腺切除术可以缩短手术时间,减少术中失血,但在早期功能恢复以及肿瘤效果方面并无明显优势。无论何种手术方式,经验丰富的外科医师,术后病理切缘阳性的比例较低,对肿瘤的控制更好。
治疗方式的选择应基于多学科医师与患者的充分交流,包括泌尿外科、放疗科、肿瘤内科以及影像科,内容应包括各种治疗方式的获益以及可能的并发症。
1. 低危前列腺癌
由于根治性前列腺切除术围手术期存在并发症的可能,根治性前列腺切除术应用于预期寿命 10 年或 10 年以上的患者。有研究指出,接受根治性前列腺切除术患者的 15 年前列腺癌特异性死亡率低达12%,而低危患者仅为5%。
一项在695例早期前列腺癌患者(大多数为 T2 期)中实施的随机临床试验,对比了根治性前列腺切除术和观察等待两种方法的治疗效果。经过 12.8 年的中位随访时间后,根治性前列腺切除术组患者的肿瘤特异性生存率、总生存率以及转移和局部进展风险出现了显著改善。在 23 年的随访中死亡率显著降低,绝对差异为 11%。总体上需要治疗 8 例患者以防止1例死亡;而对于65岁以下的患者,需要治疗 4例患者而防止1例死亡。该研究结果支持根治性前列腺切除术作为临床局限性前列腺癌的治疗选择。
低危前列腺癌,病理盆腔淋巴结阳性率小于5%,手术中没有必要行盆腔淋巴结清扫术。
2. 中危前列腺癌
一项SPCG-4研究表明,对于中危局限性前列腺癌,根治性前列腺切除可以在术后18年时降低总死亡率、肿瘤特异性死亡率以及远处转移率。而另一项PIVOT研究表明,根治性前列腺切除可以在术后10年时降低总死亡率,但并不降低肿瘤特异性死亡率。
中危前列腺癌淋巴结阳性的比率在3.7%与20.1% 。如果评估淋巴结阳性风险超过5%,在根治性前列腺切除术的同时应进行扩大淋巴结清扫,其他情况可以不做。
3. 高危前列腺癌
尽管并不是所有高危前列腺癌患者,根治性前列腺切除术后预后都较差,但这类患者术后PSA复发、需要术后辅助治疗、疾病转移进展以及死亡的危险较高。高危前列腺癌的治疗尚无统一的标准方案。对于肿瘤并没有固定盆壁,或者肿瘤未侵犯尿道括约肌的患者,根治性前列腺切除术仍是一个合理的选择。由于高危前列腺癌盆腔淋巴结阳性的可能性为15%~40%,对于所有这类患者,根治性手术同时都应同时实行扩大盆腔淋巴结清扫术。
4. 盆腔淋巴结清扫术
目前尚无足够的证据证实根治性前列腺切除术中同时行盆腔淋巴结清扫术会有肿瘤治疗效果方面的获益。然而目前普遍认为淋巴结清扫术可以提供明确的病理分期以及预后的数据,其他任何现有的方法都无法代替。专家组建议使用在纪念斯隆-凯特琳癌症中心开发的列线图来预测淋巴结转移的风险,包括治疗前 PSA、临床分期和 Gleason评分。是否实施淋巴结清扫术应按淋巴结转移的概率来决定,可应用2%或者5%做为淋巴结清扫术的的临界点。
淋巴结清扫术都应当采用扩大的盆腔淋巴结清扫术,清扫范围包括:上界为髂外静脉,外侧界为盆壁,内侧界为膀胱壁,下界为为盆腔底部,远端为库柏氏韧带,近端为髂内动脉。有几项研究支持扩大的淋巴结清扫术具有生存优势,这可能是由于切除了微小转移病变。淋巴结清扫术可通过腹腔镜、机器人辅助腹腔镜或者开放手术完成,这三种手术方式的并发症发生率相似。
有研究表明,对于cN0的患者,根治性前列腺切除术中行淋巴结清扫术证实为pN1,15年的肿瘤特异性生存率和总生存率分别为45%和42%。
淋巴结清扫的个数,阳性淋巴结的个数,淋巴结内肿瘤所占体积以及肿瘤是否侵犯淋巴结被膜是pN1患者根治性前列腺切除术后早期复发的预测因素。阳性淋巴结的密度大于20%提示预后不良。
5. 根治性前列腺切除术后辅助治疗
对于术后pT3 pN0的患者,由于切缘阳性(影响最大)、肿瘤突破包膜、或者侵犯精囊等因素术后局部复发的风险较高,尽管PSA < 0.1 ng/ml,应考虑针对前列腺窝的辅助放疗或者挽救性放疗。辅助应用内分泌治疗可能具有无疾病进展生存(PFS)优势,但没有总生存期(OS)优势。
对于pN1的患者,根治术后早期联合辅助内分泌治疗10年的肿瘤特异性生存率可以达到80%,这种肿瘤特异性生存率和总生存率的提高已经在前瞻性随机对照临床研究中证实。
对于pN1的患者,术后辅助放疗可能获益。然而,受益程度主要取决于肿瘤的特点,如3~4个以下阳性淋巴结,Gleason评分7~10分,pT3~4期,以及切缘阳性。SEER数据库回顾性研究指出,根治术后辅助放疗,总生存期有提高的趋势,无统计学显著意义,而肿瘤特异性生存无明显延长。辅助放疗的放射范围尚无统一意见,大多数采取整个盆腔放疗。
根治术后的辅助化疗尚无明确结论,仍处于临床试验阶段。
6. 保留性神经手术的适应证
大多数局限性前列腺癌都可以采取保留性神经的根治性前列腺切除术,明确的手术禁忌证是包膜外受侵高风险的患者,如cT2c或者cT3期前列腺癌,或者是活检Gleason评分7分以上前列腺癌。术前mpMRI可能对选择患者有所帮助,如果术中发现可能残存肿瘤,术者应切除血管神经束,术中冰冻可能对这些决策有所帮助。
7. 放疗后生化复发的手术治疗
根治性前列腺切除术是前列腺癌外放疗后生化复发患者的一种挽救性治疗,但是与根治性前列腺切除术做为初始治疗相比,其并发症(包括尿失禁、勃起功能障碍和膀胱颈挛缩)发生率仍较高。10年总生存率和肿瘤特异性生存率分别是 54%~89% 和 70%~83%。患者的选择非常重要,挽救性前列腺切除术应由经验丰富的外科医师进行。
(三)外放射治疗(external beam radio-therapy,EBRT)
根治性外放射治疗:根治性EBRT与根治性前列腺切除术相似,是前列腺癌患者最重要的根治性治疗手段之一。主要有三维适形放射治疗(three-dimensional conformal radiotherapy,3D-CRT)和调强适形放疗(intensity modulated radiotherapy,IMRT)、图形引导下放射治疗(image guided radiation therapy,IGRT)等技术,目前已成为放射治疗的主流技术。EBRT具有疗效好、适应证广、并发症及不良反应小等优点。对于低危前列腺癌患者能达到与根治性手术治疗相似的疗效。根据放疗治疗目的不同,EBRT分为三类,根治性放疗,是局限性和局部进展期前列腺癌患者的根治性治疗手段之一;术后辅助和术后挽救性放疗;转移性癌的姑息性放疗,以减轻症状、改善生活质量。
1. 根治性外放疗的适应证
局限性前列腺癌:低危患者(T1~2a,Gleason ≤6,PSA<10 ng/ml):外放射治疗和根治性前列腺切除术均为首选方法,高龄患者首选根治性外放射治疗。中危患者(T2b或Gleason 7或PSA 10~20 ng/ml):放疗和手术均为首选方法,高龄患者建议首选根治性外放射治疗,可选择联合短程新辅助/同期/辅助内分泌治疗(4~6个月)。高危患者(≥T2c或Gleason≥8或PSA>20 ng/ml):首选外放射治疗,需联合长程新辅助/同期/辅助内分泌治疗(2~3年),但可选择手术。
局部进展期前列腺癌(T3~4N0M0):首选根治性外放射治疗,需联合长程新辅助/同期/辅助内分泌治疗(2~3年)。
在过去的几十年间随着 RT 技术的发展,已能够安全地采用较高的放射剂量进行治疗。三维适形放疗 (3D-CRT)使用计算机软件,结合治疗部位内部解剖 CT 图像,能够以较低的迟发性反应风险,施加更高的累积剂量。第二代三维技术[调强放疗(IMRT)]在实际应用中越来越多,因为在部分而非所有研究中,IMRT与 3D-CRT 相比降低了胃肠道毒性风险。对于 3D-CRT 或 IMRT,必须每日采用影像引导放疗技术(IGRT)进行前列腺定位,以达到靶区边界缩小和治疗精确的目的。常规采用的 70 Gy 剂量被认为已经不够。对于低危患者适合采用 75.6~79.2 Gy 的总剂量,常规分次照射前列腺(包括或不包括精囊)。中危和高危患者可接受最高达 81.0 Gy 的放疗剂量。
大分割影像引导 IMRT 方案(每次 2.4~4 Gy,共4~6周),其疗效和毒性与常规分割 IMRT 相似。可以考虑使用这些放疗技术代替常规分割方案,临床随机试验的结果已表明,剂量提升与生化结果的改善具有相关性。
立体定向体部放疗 (SBRT)是一种新兴的治疗技术,在 5 次或更少次数分割治疗中提供高适形、高剂量辐射,只有在精确的影像引导,这种治疗才是安全的。与标准放疗技术相比,SBRT 具有较好的无生化进展生存率和相似的早期毒性(膀胱、直肠和生活质量)。但与IMRT 相比,SBRT 可能不良反应相对更加严重。
2. 外放射治疗并发症
放疗引起的不良反应与单次剂量和总剂量、放疗方案和照射体积有关。急性期常见的不良反应包括尿频、血尿、腹泻、便血等,放疗结束后数周基本消失。晚期副反应包括直肠出血,放射性膀胱炎出血等。采用适形放疗和调强放疗技术治疗后上述并发症发生率显著降低,但盆腔放疗可能增加患者患直肠癌或膀胱癌等第二原发肿瘤的风险。
3. 根治术后即刻或者辅助放疗
对于包膜外侵犯pT3,Gleason评分> 7分,以及切缘阳性R1的患者,术后5年局部复发的概率高达50%。全球范围内主要有3项RCT研究涉及这类患者术后辅助放疗的问题。目前的结论是对于pT3 pN0患者,术后PSA水平< 0.1 ng/ml,由于切缘阳性(最重要的因素)、包膜侵犯和(或)侵犯精囊而引起局部复发的风险较高,目前可以有两种选择与患者交流:①在排尿功能恢复后即刻对手术区域进行辅助放疗。②临床上密切随访,在PSA超过0.5 ng/ml时开始进行挽救性放疗。
4. 远处转移的放射性治疗
对于前列腺癌的骨转移,放疗是一种有效的姑息疗法。孤立的有症状的骨转移病灶可通过 EBRT 治疗。通常可以采用短疗程照射治疗伴骨转移前列腺癌对于非椎体转移的患者,根据美国放射学会的治疗指南,大部分都应当采用单次 8 Gy 治疗。
(四)近距离放射治疗
近距离放射治疗(brachytherapy)是一种治疗局限性前列腺癌的技术手段,通过三维治疗计划系统的准确定位,将放射性粒子植入前列腺内,提高前列腺的局部剂量,减少直肠和膀胱的放射剂量,其疗效肯定、创伤小,尤其适合于不能耐受根治性前列腺切除术的高龄前列腺癌患者。
传统上近距离放疗用于低风险病例,因为早期研究发现对于高风险患者,近距离放疗的疗效低于 EBRT。但是,越来越多的证据表明,随着近距离放疗的技术进步,在高危局限性和局部晚期前列腺癌中,近距离放疗也能发挥一定的作用。目前主要有两种前列腺近距离放疗方法:低剂量 (LDR)和高剂量 (HDR)近距离放疗。
LDR 近距离放疗包括在前列腺中放置永久性粒源植入物。从这些低能量场源发射的小范围辐射允许将足够的放射剂量作用到前列腺内的病变,避免了膀胱和直肠的过度照射。
永久性近距离放疗作为一种单一疗法,适合治疗低危患者(cT1c~T2a、 Gleason 分级为 ≤6、 PSA < 10 ng/ml)。对于中危前列腺癌,近距离放疗可结合 EBRT (45 Gy),以及加用或不加用新辅助 ADT。高危患者通常被认为不适合单纯使用永久性近距离放疗。
前列腺过大或过小、有膀胱出口梗阻症状(国际前列腺症状评分较高)、或之前接受过 TURP 的患者并非近距离放疗的理想候选者。对于这些患者,植入可能会更困难,且发生副作用的风险增加。
HDR 近距离放疗是指临时插入辐射源,是对高危前列腺癌患者在EBRT 治疗中的一种增强剂量的新方法。联用 EBRT(40~50 Gy)和 HDR近距离放疗,可在高危局限性或局部晚期前列腺癌患者中提高放射剂量,同时最大限度地减少急性或晚期毒性。
近距离放疗联合EBRT,同时加入ADT(2 或 3 年)是治疗高危患者的常见方案。三种治疗联合应用效果较好,有研究表明9 年无疾病进展生存率和疾病特异性生存率分别达 87% 和 91%。与 LDR 近距离放疗相比,HDR近距离放疗患者尿频、尿急和直肠疼痛的风险更低。 有研究指出HDR 近距离放疗后勃起功能障碍风险低于 LDR 近距离放疗。
(五)质子治疗
早在上世纪五十年代就开始应用质子束放疗治疗癌症患者。质子治疗的支持者认为,这种形式的放疗在某些临床情况下可能优于 X 射线(光子)为基础的放疗。质子治疗可以将高度适形的放射剂量送到前列腺。以质子为基础的治疗在前列腺周围正常组织照射到剂量更低。然而,这些组织并不是前列腺放疗不良反应的常规致病因素,所以降低对这些非关键组织的剂量,益处并不明显。美国放射肿瘤协会(ASTRO)认为质子束治疗与其他前列腺癌治疗的疗效比较尚无明确结论。因此目前可用的治疗方案中,质子束治疗局限性前列腺癌的作用尚不明确。虽然质子束治疗不是一种新技术,但其在治疗前列腺癌中的应用还要继续发展。ASTRO 强烈支持对临床试验中的患者数据进行开发,对达成质子治疗前列腺癌的共识非常必要,特别是对比较质子治疗与其他放疗方式(如 IMRT 和近距离放疗)至关重要。由于我国目前质子放疗设备普及率较低,费用昂贵,鉴于上述情况,目前并不建推荐大范围广泛开展质子治疗。
(六)局限性前列腺癌的其他治疗
对于局限性前列腺癌,除了上述提到的治疗方法以外,还相继出现了多种其他方法。目前比较成熟而且有一定数据支持的方法主要是前列腺冷冻消融(CSAP)和高能聚焦超声(HIFU)。
冷冻消融(CSAP),是通过局部冷冻来破坏肿瘤组织。有研究指出,低危患者经过冷冻治疗后5 年无生化复发率在65%~92%。冷冻治疗和根治性前列腺切除术对于单侧前列腺癌具有类似的肿瘤治疗结果。有研究对比了T2 或 T3期前列腺癌患者冷冻治疗和EBRT的治疗效果。所有患者均接受新辅助 ADT治疗。结果显示在 3 年总生存期和无疾病生存期上都无显著差异,接受冷冻治疗的患者治疗后性功能较差。但也有研究发现,冷冻消融相比 EBRT 无生化进展生存率较低,尽管肿瘤特异性生存期和总体生存期相似。
CSAP 潜在的适应患者包括局限性前列腺癌,PSA < 20 ng/ml,Gleason评分< 7分,低危前列腺癌或者中危前列腺癌患者但身体状况不适合放疗或者手术治疗,前列腺体积< 40 ml。目前尚无10年以上有关肿瘤治疗效果的长期数据,因此对于预期寿命10年以上的患者,应充分告知。
高能聚焦超声(HIFU)是利用超声波,通过机械作用和热作用损伤肿瘤组织,达到治疗作用。
HIFU 目前已经用于前列腺癌的初始治疗以及放疗后复发。一项前瞻性研究显示,111 例局限性前列腺癌患者使用 HIFU。2 年无其他根治治疗生存率为89%,12 个月时患者保留控尿功能和勃起功能的比例分别为97% 和78%。在中位随访 64 个月后,48%的患者避免应用ADT治疗。
HIFU也可用于放疗后复发的患者。研究指出,HIFU 治疗后,中位无生化复发生存期为63 个月,5 年总生存率88%,肿瘤特异性生存率94%。在中位随访 64 个月后,48%的患者避免应用ADT治疗。
其他新兴的局部疗法,如血管靶向光动力学(VTP)治疗,值得进一步研究。一项多中心、开放、3 期随机对照试验中,413例低危前列腺癌患者随机接受 VTP 治疗(静脉注射帕利泊芬,光纤插入前列腺中,随后激光激活)或动态监测。中位随访 24 个月后,VTP 组中28%的患者疾病进展,而主动监测组为58%。VTP 组中前列腺再次活检结果阴性更为普遍。 VTP 组最常见的严重不良反应是尿潴留,均在2个月内缓解。
(七)雄激素剥夺治疗
雄激素剥夺治疗(ADT)作为晚期前列腺癌患者的主要全身性治疗,或者作为新辅助/辅助治疗联合放疗,用于治疗局限性或局部晚期前列腺癌。
公认的去势水平的定义是睾酮< 50ng/dl(1.7 nmol/L),这是40多年前制定的标准,当时的检测技术水平有限。现有的方法证实手术去势后睾酮的平均水平是 15 ng/dl,因此睾酮<20ng/dl(0.7nmol/L)应该是比较合理的去势水平。目前也有很多研究结果证实,睾酮水平越低,治疗效果越好。
1. ADT 类型
ADT 可采用手术去势(双侧睾丸切除术)或药物去势,包括促黄体素释放素(LHRH,也被称为促性腺激素释放激素或 GnRH)激动剂或拮抗剂,两者显现出同等效果。对于明显转移且有可能因初期单纯使用 LHRH 激动剂治疗引起睾酮急剧增加而出现相关症状的患者,抗雄激素治疗应当与初始LHRH激动剂同时开始,或者提前开始,并应当持续这种联合治疗至少 7天的时间,以阻断配体与雄激素受体的结合。与LHRH激动剂先激发LHRH受体再引起性腺功能低下不同,LHRH拮抗剂开始即迅速并直接地抑制雄激素的释放。因此,使用这类药物的初始睾酮不会急剧增加,因此也不必与抗雄激素一起共同给药。
最近的证据表明,睾丸切除术可能比 LHRH 激动剂更安全。睾丸切除术后患者出现骨折、外周动脉疾病和心脏相关并发症风险较低,两种方法出现糖尿病、深静脉血栓形成、肺栓塞和认知障碍等风险类似。
药物去势或手术去势联合一种抗雄激素制剂被称为联合雄激素阻断。目前为止尚无前瞻性随机研究证实联合雄激素阻断比按顺序使用LHRH激动剂和抗雄药物有生存优势。荟萃分析数据提示比卡鲁胺可能会使总体生存率相对于使用LHRH激动剂单药治疗改善5%到 20%,但是需要临床试验对这一假设进行检验。抗雄药物单药治疗的有效性不如药物去势或手术去势,因此不推荐作为主要 ADT。
2. ADT 治疗低危前列腺癌患者
在社区医院中,ADT常常用来治疗早期低危前列腺癌,尤其是老年人。然而这种做法已受到研究结果的质疑。一项包括 66 717 位 T1~T2 期前列腺癌的老年患者的研究发现,接受ADT治疗的患者与单纯采取观察的患者相比,15年后并无生存获益。类似研究也发现临床局限性前列腺癌患者不能单纯从ADT治疗中得到生存获益。 ADT治疗不应成为早期前列腺癌患者的常规治疗方法。
3. ADT 治疗中危前列腺癌
目前为止主要有三项随机临床试验证实,短期ADT 加入放疗后可改善总生存和肿瘤特异性生存[Tran Tasman 放射肿瘤组(TROG)9601、Dana Farber 癌症研究所 (DFCI)95096、肿瘤放射治疗协作组(RTOG)9408]。总体结果显示,对于中危前列腺癌患者,4个月的ADT治疗联合EBRT,可以改善患者总生存,但在此基础上加用紫杉醇、雌莫西汀和依托泊苷(TEE)的化疗,并不能改善生存。
4. ADT 治疗高危前列腺癌
ADT 联合 EBRT 是高危或极高危患者的一种有效的主要治疗。在多项随机三期研究中,这种联合治疗的肿瘤特异性和总体生存均优于单一方式治疗组。越来越多的证据倾向于认为长期新辅助/联合/辅助 ADT 优于相应的短期治疗,目前认为ADT治疗应持续2~3年。经选择的病例还可以考虑在ADT 联合 EBRT治疗的同时,加用6周期多西他赛化疗。此外,对于这类患者,还可以考虑EBRT联合近距离放疗,加用或者不加用新辅助/联合/辅助 ADT治疗。此外,对于年轻的高危前列腺癌患者,根治性前列腺切除术+盆腔淋巴结清扫术也是一种治疗选择,年轻和身体健康的患者可以从中获益。
5. ADT 治疗极高危前列腺癌
该类患者的治疗选择包括EBRT联合长期ADT治疗;EBRT联合近距离放疗,加用或者不加用长期ADT治疗;年轻和身体健康的患者行根治性前列腺切除术+盆腔淋巴结清扫术(肿瘤未固定盆壁);对于不适合行根治性治疗的患者,可考虑ADT或者观察等待。对于部分患者可考虑在EBRT治疗后,持续ADT治疗同时,加用6周期多西他赛化疗。
6. ADT 治疗淋巴结转移和转移性前列腺癌
ADT治疗或者是EBRT联合2~3年新辅助/联合/辅助 ADT治疗,是淋巴结转移性前列腺癌的治疗选择。ADT是转移性前列腺癌的治疗选择。
7. ADT治疗下原发病灶的处理
美国SEER数据库和德国慕尼黑肿瘤登记数据库的回顾性研究都显示,在新诊断的转移性前列腺癌患者中,一小部分患者可以从根治性切除切除术或者近距离放疗中,有总生存和肿瘤特异性生存方面的获益。也有小样本对前瞻性研究发现,对于部分有选择的转移性前列腺癌患者,骨转移灶在3处以下,ADT治疗6个月后,进行前列腺根治切除,可以有更好的肿瘤特异性生存。当然目前这些结论依旧是试验性的,有待大规模前瞻性研究进一步证实。
8. ADT 治疗生化复发
根治性治疗后只有PSA水平升高,但没有临床复发或转移证据也无肿瘤症状的患者,是否使用ADT治疗尚无统一意见。这些患者中有一些最终因癌症而死亡。对于仅有PSA水平升高的患者,使用ADT治疗的时机受到PSA增长速度、患者和医师焦虑程度、ADT的副作用、以及患者潜在并发症等因素的影响。早期ADT是可以接受的,部分患者也可以选择密切观察至癌症进展,届时考虑采用适当的治疗方案。早期使用ADT治疗可能比延迟治疗要好,虽然对早期和晚期的定义(即 PSA 水平)仍存在争议。PSA 升高和(或) PSA 倍增时间较短、预期寿命较长的患者,应当鼓励其考虑尽早接受ADT治疗。
9. 间歇ADT治疗与持续内分泌治疗
在大多数研究中,与常规连续性给药方法相比,间歇ADT治疗会带来生活质量方面的改善,但也有一些研究得出相反结论,但间歇ADT治疗无生存期优势。因此,对于有转移的前列腺癌患者,间歇ADT治疗仅在不良反应严重的患者中考虑使用,并且要与患者充分交流。
10. ADT治疗与化疗联合应用
目前已经有三项大型的随机对照研究,比较单纯应用ADT与ADT联合应用多西他赛方案化疗治疗转移性前列腺癌的效果,包括GETUG 15、CHAARTED和STAMPEDE研究,根据这些研究的数据,目前多西他赛方案化疗联合ADT应该是初诊转移性前列腺癌患者的标准治疗方案,尤其对于高转移负荷的前列腺癌患者,更是如此。
11. 传统ADT的不良反应
ADT可产生各种不良反应,包括热潮红、血管舒缩不稳定、骨质疏松、较高的临床骨折发生率、肥胖、胰岛素抵抗、血脂改变、糖尿病、肾脏损伤和心血管疾病等风险。最近的证据提示在ADT和认知功能减退或未来阿尔茨海默氏病之间可能存在联系,总体而言,持续使用 ADT 的副作用随着治疗时间的延长而增加。
12. ADT中的骨骼健康
ADT与更高的临床骨折风险有关。例如,在大规模人群研究中,ADT与骨折风险相对增加21%~54%。长时间的治疗时间使骨折的危险性更大。ADT 加速骨代谢并降低骨矿物质密度,建议按照骨质疏松症的推荐:
1)所有50岁以上的男性补充钙(每日1200 mg)和维生素 D3(每日800~1 000 IU)。
2)当男性髋骨骨折的10年可能性≥3%或严重骨质疏松症相关性骨折的10年可能性≥20%时,便应给予额外治疗。
目前,如果药物治疗会引起绝对骨折风险,建议采用地诺单抗(每 6个月 60 mg)、唑来膦酸(每年 5 mg 静注)或阿屈磷酸盐(每周 70 mg 口服)治疗。
13. ADT与糖尿病和心血管疾病
研究显示,ADT与较高的糖尿病和心血管疾病发生率相关。 ADT 治疗期间较高的糖尿病和心血管病风险可由几种机制进行说明。ADT增加脂肪量,增加空腹血浆胰岛素水平,并降低胰岛素灵敏度。ADT 还增加血清胆固醇和甘油三酯水平。心血管疾病和糖尿病是普通人群发病率和死亡率的主要原因。根据所观察到的由 ADT 引起的不良代谢反应以及 ADT 与较高糖尿病和心血管疾病发生率间的相关性,建议对接受 ADT 治疗的患者进行筛查和干预以预防/治疗糖尿病和心血管病。
(八)去势抵抗性前列腺癌的治疗
1. 去势抵抗性前列腺癌(CRPC)的定义
CRPC是指睾酮达到去势水平后(< 50 ng/dl或1.7 nmol/L),至少出现下面情况的一种:
1)生化复发:间隔1周以上连续3次PSA上升,2次升高均在PSA低点50%以上,并且PSA> 2 ng/ml。
2)影像学进展:新发病灶的出现,包括骨扫描提示2处或以上的新发骨转移病灶,或者是应用RECIST标准评价的新发软组织病灶。单纯症状上进展不能够诊断为CRPC,需要进一步的评估。
2. 无症状非转移性CRPC(M0 CRPC)
相对频繁的治疗后PSA监测,使得CRPC可以更早的发现,有研究表明,PSA开始上升的2年内,约有三分之一的患者会发生骨转移。
最新两项有关M0 CRPC的临床研究,改变了这类患者的标准治疗方案。阿帕鲁胺(apalutamide)是一种新的非甾体雄激素受体阻断剂,其与雄激素受体的结合力是比卡鲁胺的7~10倍,能够强效抑制雄激素受体的功能。SPARTAN是多中心、双盲、安慰剂对照的Ⅲ期临床研究,观察阿帕鲁胺在M0 CRPC中的疗效。研究共纳入了1207例M0 CRPC患者,PSA倍增时间小于10个月,按照阿帕鲁胺和安慰剂2∶1的比例入组。所有患者均维持内分泌治疗。结果显示,无转移生存时间在阿帕鲁胺组为40.5个月,安慰剂组为16.2个月(HR 0.28,P<0.001),次要观察终点如症状进展时间(HR 0.45,P<0.001)、出现转移时间(HR 0.27,P<0.001)在阿帕鲁胺组也是显著延长的。总生存(OS)数据在研究报道时尚不充分,但差异没有显著性(HR 0.70,P=0.07),有待进一步随访观察。安全性方面,由于不良反应而停止治疗的患者比例在阿帕鲁胺组为10.6%,安慰剂组为7.0%。阿帕鲁胺组常见的副反应为乏力、高血压、皮疹等,需要指出的是阿帕鲁胺组出现甲状腺功能减退的比例为8.1%,高于安慰剂组的2%,提示今后临床使用阿帕鲁胺时需要加强对甲状腺功能的监测。
恩杂鲁胺也是新的非甾体雄激素受体阻断剂,其与雄激素受体的结合力是比卡鲁胺的5~8倍,也能够强效抑制雄激素受体的功能。恩杂鲁胺有关M0 CRPC的研究有STRIVE研究和PROSPER研究。STRIVE研究入组了转移性CRPC和M0 CRPC患者,观察恩杂鲁胺和比卡鲁胺的疗效差异。结果显示,在研究发表时,M0 CRPC患者中恩杂鲁胺组中位无进展生存(PFS)没有达到,但显著长于比卡鲁胺对照组的8.6个月(HR 0.24,P<0.001),PSA下降超过50%和90%的比例在两组分别为91%对42%、76%对12%。该研究没有报道OS数据。PROSPER研究是一项多中心、随机、安慰剂对照的Ⅲ期临床研究,目前PROSPER研究的结果没有正式发表。该研究的入组标准与SPARTAN研究类似,无转移生存时间在恩杂鲁胺组显著延长(36.6个月对14.7个月,HR 0.29,P<0.001),至PSA进展的时间分别为37.2个月对3.9个月(HR 0.07,P<0.001),中期分析没有发现两组在OS方面存在显著差异。
基于上述Ⅲ期临床研究,对于转移风险较高(PSADT小于10个月)的M0 CRPC患者的标准治疗是在ADT治疗的基础上联合阿帕鲁胺或恩杂鲁胺。考虑到积极联合治疗的OS尚没有显著差异,因此对这类患者在ADT治疗基础上观察也是一种推荐意见。
考虑到阿帕鲁胺和恩杂鲁胺是通过进一步抑制雄激素信号通路来延缓M0 CRPC患者的肿瘤进展,因此在逻辑上采用阿比特龙治疗也可能起到类似作用。IMAAGEN研究证实了这一想法。该研究是单臂研究,入组132例M0 CRPC患者,采用阿比特龙联合泼尼松治疗后,PSA下降大于50%和90%的比例分别为86.9%和59.8%,中位PSA进展时间为28.7个月。因此,对于临床上获得阿帕鲁胺或恩杂鲁胺困难、又不愿意接受观察的患者,可以选择使用阿比特龙联合泼尼松治疗。
既往对这类患者可以选择使用一代抗雄药物或酮康唑治疗,但没有生存获益的依据。
另外需要指出的是,在上述研究中,筛查转移灶使用的是传统的影像学工具,如CT、MRI、骨扫描等。但随着PET-CT 在临床的应用开展,一些患者采用传统影像学检查没有发现转移灶,而PET-CT 却发现转移灶,这些患者实际上是有转移的CRPC,不能完全照搬上述研究结论,需要临床积极治疗,密切随诊。
对转移风险高的M0 CRPC患者的治疗意见总结如下。
(1)建议使用阿帕鲁胺或者恩杂鲁胺。
(2)在上述两种治疗策略临床实行困难时可以选择使用阿比特龙联合泼尼松治疗。
(3)若因为各种原因不接受上述治疗,也可以选择持续内分泌治疗的基础上观察。
(4)不建议在临床试验之外使用化疗或者免疫治疗。
3. 转移性CRPC
(1)CRPC患者去势治疗的作用
前列腺癌最终进入CRPC阶段,仅有两项研究证实了在二三线治疗中维持去势治疗的较微弱的生存优势。然而在缺乏前瞻性研究的前提下,维持去势治疗可能获得的收益超过治疗可能带来的风险,目前所有的临床研究也都基于维持去势水平,因此在这类患者人群中应维持去势治疗。
(2)转移性CRPC的常用一线治疗药物
①阿比特龙
2011 年 4 月,FDA 批准了雄激素合成抑制剂醋酸阿比特龙(阿比特龙)联合低剂量强的松用于治疗存在转移性 CRPC 的患者,这些患者之前曾接受含有多西他赛的化疗案。FDA 批准阿比特龙用于多西他赛治疗后的患者,是基于在先前曾接受含多西他赛方案化疗的转移性 CRPC 患者中实施的一项三期随机安慰剂对照临床试验(COU-AA-301)的结果。患者随机分组接受每日一次口服 1000 mg 阿比特龙 (n = 797)或每日一次安慰剂 (n = 398),且两组每日均接受泼尼松治疗。在最后的分析中,阿比特龙和安慰剂组的中位生存期分别为 15.8个月对11.2 个月(HR 0.74; 95% CI 0.64-0.86;P<0.0001)。阿比特龙组在影像学进展时间、 PSA 下降程度和疼痛缓解方面也有所改善。
2012 年 12 月 10 日,FDA 批准对多西他赛化疗前应用阿比特龙,这是基于在无症状性或轻度症状转移性 CRPC 患者中实施阿比特龙和泼尼松(n = 546)对比单纯泼尼松(n = 542)的一项三期随机 COU-AA-302 试验的结果。这个试验中大部分患者不使用麻醉药物缓解癌症疼痛,并且无内脏转移,未接受过酮康唑治疗。治疗后,共同主要终点影像学无进展生存期由 8.3 个月增加至 16.5 个月(HR 0.53;P < 0.001)。中位随访 49.2 个月时,最后分析的总体生存期得到改善(34.7个月对 30.3 个月; HR 0.81;95% CI 0.70~0.93;P = 0.003)。症状恶化的时间、化疗开始的时间、疼痛进展的时间和 PSA 无进展生存期等关键次要终点在阿比特龙治疗后显著改善,PSA 降低(62% 对 24%,>50% 降低)和影像学缓解(36% 对 16% RECIST 缓解)更常见。
阿比特龙/泼尼松最常见的不良反应是疲劳 (39%);背部或关节不适(28%~32%);外周性水肿 (28%);腹泻、恶心或便秘 (22%);低血钾 (17%);低血磷 (24%);房颤(4%);肌肉不适(14%);热潮红(22%);尿路感染;咳嗽;高血压(22%,4%出现严重高血压);尿频和夜尿增多;消化不良;或上呼吸道感染。导致停药的最常见药物不良反应包括谷草转氨酶和(或)谷丙转氨酶水平升高(11%~12%)或心脏疾病(19%,6% 为严重)。因此,在阿比特龙/泼尼松治疗期间,至少初始仍需按月监测肝功能、血钾和血磷水平以及血压。也需对心脏疾病进行对症评估,尤其是对既往存在心血管疾病的患者。
②恩杂鲁胺
2012 年 8 月 31 日,FDA 批准恩杂鲁胺用于治疗转移性CRPC患者,这些患者之前曾接受含有多西他赛的化疗方案。该批准是基于一项三期随机安慰剂对照试验 (AFFIRM)的结果。AFFIRM按2:1的比例随机将1199 位患者分为恩杂鲁胺组和安慰剂组,并且主要终点是总体生存期。恩杂鲁胺治疗后,中位生存期从13.6个月增加至18.4个月(HR 0.63;P < 0.001)。生存期在所有被分析的亚组中均得到改善。次要终点也显著改善,包括 PSA 降低 > 50% 的患者比例(54% 对 2%)、影像学缓解(29%对4%)、影像学无进展生存期(8.3对2.9个月)和至首次 SRE 时间(16.7月对13.3个月)。生活质量使用验证过的调查进行评估,恩杂鲁胺与安慰剂相比在生活质量上出现改善。不良事件为轻度,包括疲劳(34%对29%)、腹泻(21% 对 18%)、潮热(20% 对 10%)、头痛(12% 对 6%)和癫痫(0.6% 对 0%)。两组间的心脏疾病发生率没有差异。
恩杂鲁胺的剂量为每日 160 mg。 AFFIRM 研究中的患者维持 GnRH 激动剂/拮抗剂治疗,并且可以接受骨骼支持治疗药物。
另一项三期试验在化疗开始前研究了恩杂鲁胺的作用。 PREVAIL 研究将 1717位化疗初治的转移性前列腺患者随机分配接受每日恩杂鲁胺或安慰剂。该研究由于治疗组中显示的获益而提前终止。与安慰剂组相比,恩杂鲁胺组显示中位无进展生存期(20.0 个月比 5.4 个月)和中位总生存期(35.3 个月比 31.3 个月)改善。同样观察到了所有的次要终点的改善(如直到开始化疗或首次 SRE 的时间)。
另外两项随机临床试验报告,恩杂鲁胺对转移性CRPC 的控制可能优于比卡鲁胺。TERRAIN研究中,375例初治的转移性CRPC患者按1∶1随机分配至恩杂鲁胺160mg/d或比卡鲁胺50mg/d组。与比卡鲁胺相比,恩杂鲁胺组的无进展生存期(定义为 PSA 进展、软组织进展或发生另外的骨转移)显著优于比卡鲁胺组(至进展中位时间15.7比5.8个月;HR为0.44; 95%CI 0.34~0.57)。STRIVE 研究中,396例初治的M0或M1 CRPC患者按 1:1 随机分配至恩杂鲁胺160mg/d或比卡鲁胺50mg/d组。本研究的主要终点是无进展生存期,与比卡鲁胺相比,恩杂鲁胺使进展或死亡风险降低了76%(HR 0.24; 95% CI 0.18~0.32)。这些研究表明,在选择抗雄激素作为二线激素治疗CRPC患者中,恩杂鲁胺延长无进展生存期的作用优于比卡鲁胺。鉴于药剂的不同副作用特征和恩杂鲁胺的成本更高,一些患者仍可考虑比卡鲁胺。
因此,恩杂鲁胺成为多西他赛治疗前和治疗后转移 CRPC 患者的一种治疗选择,并且是不适合进行化疗患者的一个合理的选择。
③多西他赛
有 2 项三期随机临床试验,在有症状或进展迅速的患者中进行,评估多西他赛为基础的化疗方案的治疗效果 (TAX327和 SWOG9916)。TAX327研究纳入1006位患者,比较多西他赛(每 3 周或每周用药1次)+ 泼尼松与米托蒽醌 + 泼尼松。每3周1次多西他赛相比米托蒽醌获得了更高的中位总体生存期(18.9对16.5个月,P=0.009)。这种生存获益在延长随访期中得到维持。SWOG9916临床研究也显示多西他赛联合雌氮芥相比米托蒽醌+泼尼松可以更好的改善生存。多西他赛被 FDA 批准用于转移性 CRPC 的治疗。标准方案是每3周1次,替代方案是每2周1次50mg/m2方案。该方案基于一项大型 2 期随机试验,包含346位转移性CRPC患者,试验将患者随机分配到每 2 周多西他赛组或每3周的多西他赛组,每组维持ADT和泼尼松。每2周方案治疗的患者平均生存期为19.5个月,相比之下是每3周方案生存期为17.0个月(P=0.015)。每2周的治疗有更好的控制疾病进展时间和PSA下降率。此外每2周的多西他赛使患者耐受性得到改善。
此外基于最新的2项三期试验(ECOG 3805/CHAARTED 和 STAMPEDE)的结果,多西他赛化疗作为进展期激素敏感度前列腺癌患者的一线选择。
CHAARTED 将790例转移性、激素敏感性前列腺癌患者随机分配接受多西他赛 + ADT或单纯ADT治疗。联合治疗组患者总生存期比单纯ADT治疗组更长(57.6个月对44.0 个月;HR 0.61,95% CI 0.47~0.80;P<0.001)。亚组分析表明,占受试者65%的高肿瘤负荷患者的生存获益更为显著(HR 0.60;95% CI 0.45~0.81;P < 0.001)。 尽管两组的中位OS均未达到,并且患者人数较少,但也能得出结论,低肿瘤负荷的患者也可以从多西他赛化疗中得到生存获益(HR 0.60,95% CI 0.32~1.13;P=0.11)。
STAMPEDE 研究是一项多分组、多阶段的三期临床研究,包括M0和M1激素敏感前列腺癌患者。在M1患者中的结果进一步证实在CHAARTED 试验中看到 ADT 加用多西他赛所获得的生存优势。在 STAMPEDE研究中,并没有对1087例转移性前列腺癌患者按肿瘤负荷分层,但ADT+多西他赛治疗组中所有M1患者的中位总体生存期为 5.4 年,对比单纯 ADT 组的 3.6 年(组间1.8年的差异,相比之下在 CHAARTED中是1.1年的差异)。 STAMPEDE试验的结果看来证实了 CHAARTED 试验的结果。
此外,在高危或极高危局限性前列腺癌患者中,可考虑多西他赛联合ADT和EBRT治疗,这是基于GETUG 12试验的研究结果。该研究将413例高危或极高危前列腺癌患者随机分配至IMRT+ADT或IMRT+ADT+多西他赛+雌莫司汀治疗。中位随访8.8年后,联合治疗组8年无复发生存率为62%,单纯ADT组仅为50%(调整HR值为0.71;95%CI为0.54~0.94;P=0.017)。已证实雌莫司汀可增加副作用,而与多西他赛合用时并不能增强其效果,故不推荐使用。
④卡巴他赛
2010 年6月,FDA批准卡巴他赛(一种半合成的紫衫烷衍生物)用于多西他赛化疗失败的转移性CRPC患者。在一项国际Ⅲ期随机临床试验(TROPIC)中,755例进展性转移性CRPC 患者被随机分为卡巴他赛25mg/m2组或米托蒽醌 12mg/m2组,与米托蒽醌组相比,卡巴他赛组的总体生存期延长2.4个月(HR 0.72;P<0.0001)。卡巴他赛组中生存期的改善被较高的毒性死亡率抵消(4.9%对1.9%),这在很大程度上是由于败血症和肾衰引起的。接受卡巴他赛治疗的患者中有7.5%出现发热性中性粒细胞减少,而米托蒽醌治疗患者中的相应比例为1.3%。接受卡巴他赛治疗的患者中严重腹泻(6%)、疲劳(5%)、恶心/呕吐(2%)、贫血(11%)以及血小板减少(4%)的发生率也较高,这说明在此种情况下需要警惕、治疗或预防发热性中性粒细胞减少。在Ⅲ期开放国际、非劣性的PROSELICA研究中,1200例多西他赛治疗失败的mCRPC患者接受卡巴他赛 20 mg/m2和25 mg/m2 治疗并进行比较。结果发现低剂量组的中位总生存期不劣于较高剂量组[13.4个月(95% CI 12.19~14.88)比14.5个月(95% CI 13.47~15.28)],且3/4级不良事件率低(39.7%比 54.5%)。特别是,低剂量组和高剂量组的4级中性粒细胞减少率分别为21.3%和48.6%。目前推荐,卡巴他赛25 mg/m2每3周1次,仍然是目前的标准治疗方案,对于身体相对虚弱的患者,可以考虑卡巴他赛 20 mg/m2 每 3 周1次方案。
Ⅲ期FIRSTANA研究的最新结果表明,卡巴他赛对于未经过化疗的mCRPC患者具有临床意义。卡巴他赛20 mg/m2、卡巴他赛25mg/m2、多西他赛75 mg/m2治疗方案的平均总体生存期(主要终点)相似,分别为24.5 个月、25.2个月和24.3个月。卡巴他赛与多西他赛相比,周围神经病变率较低,特别是20 mg/m2(12%比25%)。因此,不适合多西他赛方案化疗或者已存在轻度周围神经病变的患者,可以考虑卡巴他赛。
⑤Sipuleucel-T
2010年4月,Sipuleucel-T做为首个新型肿瘤免疫治疗药物获得了FDA的批准。这种自体肿瘤疫苗,包括采集每一位患者的含有抗原呈递细胞的白细胞,将这些细胞暴露于前列腺酸性磷酸酶粒细胞巨噬细胞集落刺激因子(PAP - GM - CSF 重组融合蛋白),然后将这些细胞重新回输。该药物是基于一项Ⅲ期多中心随机双盲临床试验(D9902B)。512例存在轻微症状或无症状的转移性CRPC患者以2∶1的比例随机分组接受Sipuleucel - T或安慰剂。疫苗组的中位生存期为 25.8个月,与之相比,对照组为21.7个月。Sipuleucel-T 治疗使死亡风险降低了22%(HR = 0.78;95% CI 0.61~0.98;P=0.03)。常见并发症包括轻度到中度畏寒(54.1%)、发热(29.3%)和头痛(16.0%),这些并发症通常都是暂时性的。
2013 年 5 月,美国食品和药品监督管理局 (FDA)批准了二氯化镭(镭-223)的应用,这是一种能发出 α 粒子的放射性药物。这个首创的放射性药物被批准用来治疗有症状的骨转移但没有已知内脏转移的去势抵抗性前列腺癌患者。镭-223 可以显著改善整体生存率并延长首次骨相关事件(SRE)时间。镭-223 可以与阿比特龙或恩杂鲁胺联合应用,主要用于无症状的患者。
对于广泛转移的患者,采用发射 β 射线的放射性药物治疗是有效而且适当的治疗方案,尤其是当这类患者不适合进行有效化疗的时候。最常用于治疗前列腺癌骨转移疼痛的放疗药物包括锶-89(89Sr)和钐-153 (153Sm)280,由于这类患者往往存在多灶性骨痛,这种放射性全身靶向治疗可以缓解疼痛,而且不良反应较小。与发射 α 粒子的镭-223不同,放射性 β 粒子治疗并无生存优势,只能用作姑息治疗。
4. CRPC 患者的骨骼健康相关药物
一项多中心研究中,643例无症状或轻微症状的骨转移mCRPC患者,随机分组接受每3周1次的静脉唑来膦酸或安慰剂治疗。第15个月时,唑来膦酸4 mg组中出现骨相关事件(SRE)的患者人数少于安慰剂组(33%对44%,P=0.02)。 24个月时的更新报告显示至首次SRE的中位时间延长(488 天对321 天;P =0.01)。总体生存期未发现显著差异。其他双膦酸盐类尚未显示出可有效预防疾病相关性骨并发症。
一项随机、双盲、安慰剂对照研究在CRPC患者中对比了地诺单抗和唑来膦酸的疗效。两组中SRE的绝对发生率相似;然而,与唑来膦酸组相比,地诺单抗组首次SRE的中位时间推迟了3.6个月(20.7 对 17.1 个月,非劣效性 P = 0.0002,优效性 P = 0.008)。地诺单抗组的严重SRE发生率与唑来膦酸组相似,包括脊髓压迫症 (3%对4%)、需要放疗(19%对21%)和病理性骨折(14%对15%)。
针对唑来膦酸和地诺单抗所报告的治疗相关性毒性类似,其中包括低钙血症(更常见于地诺单抗,13%对6%)、关节痛和颌骨坏死(ONJ,发生率1%~2%)。虽然并非全部,大部分出现ONJ的患者之前都先有过牙齿疾病。
5. 其他新型药物
BRCA1和BRCA2基因是肿瘤抑制基因,具有维持基因组稳定性的功能。它与其他肿瘤抑制因子和信号传感器等组成复合物,在基因转录、DNA损伤修复及重组中扮演重要作用。PARP是存在于多数真核细胞中的一个多功能蛋白质翻译后修饰酶。它通过识别结构损伤的DNA片段而被激活,被认为是DNA损伤的感受器。它还能对许多核蛋白进行聚腺苷二磷酸核糖基化。受它修饰的蛋白质有组蛋白、RNA聚合酶、DNA聚合酶、DNA连接酶等,并通过组蛋白的ADP-核糖基化使组蛋白脱离下来,有助于修复蛋白的结合而进行DNA的损伤修复。同时,PARP又是细胞凋亡核心成员胱天蛋白酶(caspase)的切割底物。因此,它在DNA损伤修复与细胞凋亡中发挥着重要作用。PARP抑制剂通过抑制肿瘤细胞DNA损伤修复、促进肿瘤细胞发生凋亡,达到治疗肿瘤的目的。
奥拉帕尼(Olaparib)是一种PARP抑制剂,已有研究发现,它在BRCA1和BRCA2基因突变的CRPC患者中具有很好的治疗效果,反应率高达88%,可能成为未来mCRPC治疗的又一选择。
关注【肿瘤资讯】,公众号对话框内回复:前列腺,即可获得2018版前列腺癌诊疗规范电子版!