3篇Nature!华人学者同期发表重量级论文
在最新一期《自然》杂志上,我们很高兴地看到华人学者们能同期发表三篇重量级的论文。这些论文涵盖了多个领域,反映了华人科学家们在生物学不同方向上取得的进展。在今天的这篇文章中,我们也将和大家一道分享这三篇论文的介绍。
本文转载自“学术经纬”,原标题:今日Nature:华人学者同期发表三篇重量级论文。
1Jiandong Liu/钱莉课题组
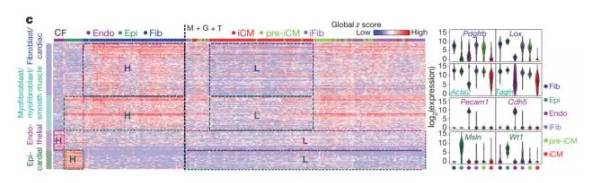
Single-cell transcriptomics reconstructs fate conversion from fibroblast to cardiomyocyte
▲Jiandong Liu博士(左)与钱莉博士(右)(图片来源:北卡罗莱纳大学教堂山分校)
近年来,我们在成纤维细胞的重新编码上取得了一系列可喜的成果,并能将它转化为一系列不同的细胞类型。然而,成纤维细胞如何逐渐改变自己的细胞命运,变身为其他细胞的过程依旧不甚明朗。由于重编码过程中的内在异质性和不同步性,我们很难使用常规的基因组学技术去挖掘背后的根源。在这项研究中,北卡罗莱纳大学教堂山分校的Jiandong Liu博士和钱莉博士所领导的团队使用单细胞RNA测序技术来攻克这一局限,获得了小鼠成纤维细胞诱导成心肌细胞过程中,早期的全转录组数据变化。随后,他们利用开发的算法,找到了诱导过程中,分子性质迥异的细胞亚群,并由此描绘出了诱导心肌细胞形成过程中的途径。进一步的研究表明Ptbp1能阻碍成纤维细胞形成心肌细胞特异的RNA剪接模式,表明了它在诱导心肌细胞中的重要作用。与之一致,当Ptbp1基因被抑制后,心肌细胞的诱导效率有所提高。这项研究表明,通过单细胞转录组分析,能让我们找到处于过渡态的细胞亚群,从而找到对于细胞诱导过程至关重要的基因通路。
值得一提的是,钱莉博士去年曾获得《科学》杂志联合设立的博雅-科学奖,她也是这个专注干细胞和再生医学领域的奖项的首名冠军得主。今日刊登在《自然》杂志上的研究成果,则是她科研道路上的又一个重要突破!
论文地址:http://www.nature.com/nature/journal/v551/n7678/full/nature24454.html#affil-auth
2Yisong Wan课题组
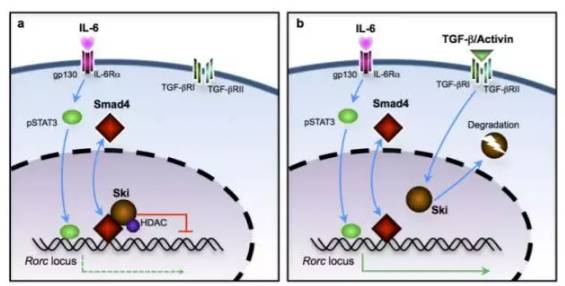
Reversing SKI–SMAD4-mediated suppression is essential for TH17 cell differentiation
▲Yisong Wan博士(图片来源:北卡罗莱纳大学教堂山分校)
辅助性T细胞17(TH17)在宿主防御、炎症反应、以及自身免疫等环节起到了重要的作用。在TH17细胞的分化中,TGFβ有着极为关键的作用,但具体的调控细节仍不清楚。在这项研究中,同样是来自北卡罗莱纳大学教堂山分校的Yisong Wan博士课题组揭示了背后的奥秘。原来,体内由SKI-SMAD4介导的信号通路能抑制关键的RORγt受体表达,而TGFβ能够“逆转”这种抑制。与这个结果相一致,在缺乏SMAD4的T细胞中,即便没有TGFβ的作用,它也能分化成TH17细胞。这项结果揭露了TGFβ控制TH17细胞分化中的关键机制,也表明SKI-SMAD4有望成为潜在的成药靶点,用于治疗和TH17相关的疾病。
论文地址:http://www.nature.com/nature/journal/v551/n7678/full/nature24283.html#affil-auth
3何跃辉课题组
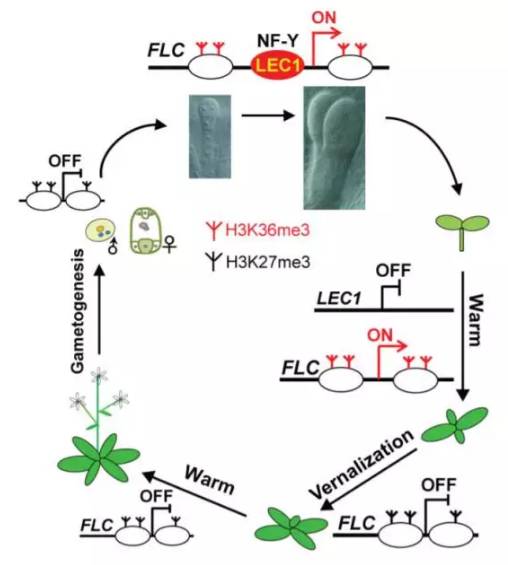
Embryonic epigenetic reprogramming by a pioneer transcription factor in plants
▲何跃辉博士(图片来源:中国科学院大学)
表观遗传学上的修饰在动物和植物的基因表达调控上有着重要作用,关键基因上表观遗传印记的传递也对细胞命运的保持有着重要意义。然而,在生长发育过程中于这些调控位点上积累的印记必须在胚胎里被去除,这样才能确保后代的发育正常。在拟南芥中,长期暴露在低温下的春化过程能沉默“成花抑制基因”FLC,从而让植物能在春暖花开之际,盛放自己的花朵。理论上说,开花后结成的种子里,FLC基因也应当处于沉默状态。然而,为何每一代植物中的FLC基因都需要重新通过春化沉默一遍呢?植物学家对背后的机制产生了好奇。中国科学院上海生命科学研究院的何跃辉博士课题组与新加坡国立大学的俞皓教授合作,发现种子特异的转录因子LEC1能让FLC基因所在的染色体区段“活化”,让FLC基因得到表达,这种表达会让合子中已发生的“沉默”失效,这就是为何每一代植物都需要重新对FLC基因进行沉默。这项研究揭露了植物胚胎染色体重编程的机制,也提供了关于表观遗传学记忆的新洞见。
论文地址:http://www.nature.com/nature/journal/v551/n7678/full/nature24300.html#affil-auth
End