仿制药全球化?行业大变革或将来临
作者 | 厚扬
2018年10月18日,FDA官网上刊登了一篇由FDA局长Scott Gottlieb博士亲自署名的文章,“Advancing Toward the Goal of Global Approval for Generic Drugs: FDA Proposes Critical First Steps to Harmonize the Global Scientific and Technical Standards for Generic Drugs(迈向全球仿制药批准的目标:FDA提出了关键的第一步,以协调全球仿制药科学和技术标准)”。仿制药全球化的课题又一次的摆上了台面,这对仿制药格局有多大影响呢?中国仿制药企又将何去何从呢?
1
事件回顾
FDA局长Scott Gottlieb博士洋洋洒洒一篇文章到底讲了什么,先来回顾下。
美国药价多年持续上涨的问题,都是历任领导人必攻的课题, 现任的FDA局长Scott Gottlieb也不例外,2017年7月18日的仿制药听证会上,Scott宣布开展“Drug Competition Action Plan(药物竞争行动计划)”,通过FDA对仿制药的审评能力和审批速度,来降低药企对仿制药的申请成本,降低仿制药进入市场的壁垒,仿制药市场的竞争扩大,对药价进行有效的降低。
在这一次的文章中,Scott提出,在2019年FDA还将推出一些新的政策,主要是FDA向ICH(国际医药法规协和会)提出探索制定仿制药全球化开发的标准。意味着,未来药企可以利用同一份仿制药的申请资料在全球多个市场进行申请批准。
全球统一标准,在其他国家研发的仿制药可以在美国市场同时寻求上市批准,扩大美国仿制药市场的竞争力;同样美国的药企,也可以同步扩展其他海外市场,同一品规的药品,全球的市场规模一下就扩张开来;扩张了药企的可售区域,自然可以减轻药企的成本,量走上去,价就下来了。
FDA之前已经采用了电子版的“共同技术文件”(eCTD),一种国际监管机构之间商定的药物申请格式,允许药企用同样的方式向多个跨国药品监管机构提交药物数据和信息申请,有效缓解药企在多地上市的成本负担。
但Scott这次特别提出,可以做的比eCTD更多,比如制定一套标准化的技术要求,被全球的市场所接受,仿制药全球化的概念第一次被提了出来。
FDA对近来的IQVIA MIDAS国际数据进行了初步的分析,对包括美国、欧盟(法国,德国,希腊,波兰和英国),日本,加拿大,瑞士和澳大利亚等十个国家进行抽样调查,发现美国销量top100种仿制药中,有5个药品没有进入加拿大市场,25个没有进入日本市场。而在美国销量最低的400个品种在其他九个国家的情况就会更差一些,其中只有35%的药物进入了其他9个国家市场,而剩余的65%并没有进入市场。
若能100%进入全球的市场,扩大仿制药的供应,市场规模提高的同时也提供了药价的竞争环境,而这是可以通过统一技术标准来实现的。
总的来说,Scott总结了4点:
1.允许研发人员使用在一个国家或地区的仿制药研发数据来进行其他地区的申请,简化仿制药的开发流程,让效益更大化。比如,通过允许统一的监管机构的研发标准,协调可以减少满足市场批准标准所需的研究(例如,生物等效性研究)的数量;
2.通过实施同时满足多个监管机构要求的共同标准,提高全球仿制药质量的一致性;
3.通过为监管机构提供更多与姐妹机构同行分享信息的机会,提高监管监督的效率(并降低成本);
4.增加仿制药全球市场规模,吸引不同仿制药开发商的竞争;从而通过增加市场进入者的数量来降低仿制药开发的固定成本并扩大患者的准入。
为了实现这些目标,FDA已经向ICH提交了一份建议书,提出了关于仿制药全球统一标准的指南,用于证明不复杂的剂型和复杂剂型以及药物等效性(如:BE),FDA还计划出台仿制药研发中所能采用的reference standard。预计ICH会在2018年11月举办的会议上评估是否批准这个提案。
若下个月进展顺利,ICH批准这个提案的话,对全球的仿制药行业来说,都是颠覆性的改革,那么ICH到底在其中扮演多重要的角色,中国的药企们又会受益其中吗?
2
ICH的影响力有多大?
“一流国家制定标准,二流国家生产和销售产品,三流国家提供原料”,标准后才是利益之争。
2017年6月中国刚加入ICH(The International Council for Harmonisation,人用药物注册技术要求国际协调会议),成为ICH的全球第8个监管机构成员。ICH最早是于1990年由美国、欧盟、日本三方联合建立而成,成立的主旨就是让不同国家对新药申报技术要求趋于一致和合理化,以加快在跨领域市场的上市速度。
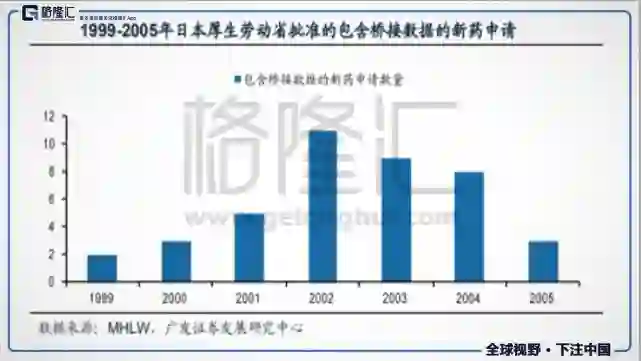
日本是当年最成功的案例,在1970s年代,日本不允许外国药企单独在日本申请药品有效性和安全性的新药临床试验,要求必须有在日本药企的参与下才可以进行,所以大部分外企选择外资代理业务,这使得日本在研发和技术上进步很慢。到了80年代,日本开始对医保开支进行控费,降价后药企的利润变少,促使药企们开始进行研发,最开始的套路是一样的,都是从仿制药先入手,逐步发展起来后,依然只能局限在国内市场,无法打开国际市场。90年代,联合创立ICH后,ICH逐步使日本的药品管理要求至国际标准。
最直接的影响就是MRCT(国际多中心临床试验),毕竟不同领域、不同人种对药物的反应可能存在差异,所以才会有每进入一个国家,都需要新的临床试验来证明安全性和有效性。MRCT的作用就在于为本土的出口和进口药品提供数据基础,可以同时关注不同地区的人种的临床试验结果,像个大数据库一样,进而得到外延的数据,提供统一临床试验结果的可信性,大幅缩短在跨领域上市的时间成本,提高效率。提供便利后,配合相应的医改,药品审批速度得到了大幅提高,医药行业发展也进入快车道。
再来看看中国情况,在进入ICH之前,美国获批的新药,在中国只有不到30%能获批上市,使得中国在过去十年的药物水平与国际相差较大,其中很重要的原因就是审评时间过长,譬如用于治疗肾炎患者甲亢症状的西那卡塞(cinacalcet)早在2004年就得到了美国FDA的批准,而它在2014年才在中国获批,中间相隔长达10年,更不用说重磅的抗癌药物的滞后,比如治疗非小细胞肺癌的厄洛替尼(erlotinib)、首个抗肿瘤血管生成药物贝伐珠单抗(bevacizumab)、治疗乳腺癌的拉帕替尼(lapatinib)与治疗白血病的达沙替尼(dasatinib),因为进口药物要进行临床试验审批,新药临床试验,新药审批,三个环节下来也差不多要5年的时间,繁琐的审批流程让进口新药的上市时间不断滞后。
去年加入ICH,对中国的制药领域到底意味着什么?很多说这是一把双刃剑,因为在此之前,中国都是遵照WHO(世界卫生组织)的准则来进行监管,而那是全球制药界最低的标准。ICH则可以理解为发达国家的最低标准,对中国的制药行业来说是非常大的一个跨步,意味着国际上(ICH)承认中国的药监水平。
受益体现最快的是创新药,在正式加入ICH之前,CFDA早已做下铺垫,将FDA等所运用的原则和内容都加入制定国内监管制度中来,在2017年3月出台的《总局公开征求《国家食品药品监督管理总局关于调整进口药品注册管理有关事项的决定(征求意见稿)》意见的通知》中,就已经嗅到眉目,新药上市从三报三批到两报两批,大幅减少上市流程,对进口创新药提供中国同步上市的有利环境,缩短与国外上市时间的差距,利福于患者。
然而,回过头来看,对仿制药来说,可能又是另一番天地。
3
仿制药的挑战
若仿制药实现全球统一标准,对仿制药药企来说,会是一把双刃剑。
近年来的医改,在一致性评价和控费的双双出台下,仿制药行业正在迎来大的整合,优胜劣汰,行业集中度的体现会越来越明显,行业的兼并重组或许会在之后大量出现。以价换量的大趋势下,本土的利润空间会下降,只有不断提高量的增长,走向海外市场,ICH就提供了另一个机会。ICH的E5《接受国外临床试验数据中有关种族因素的指导原则》和E6(药物临床试验质量管理规范)就是最好的推动力。
然后,反过来来看,国外的仿制药企进入中国市场也会更加便捷。以之前日本的例子来说,1990年日本top10中没有一家为外国公司,而不到20年的时间,日本top5中已经没有一家日本的本土公司,而90年代外企在日本的市场份额已经达到30%~45%左右。
而对于仿制药这个行业来说,有着“世界药房”之称的印度是强有力的竞争对手,目前印度生产了全球20%的仿制药,这已成为印度经济的支柱之一。印度境内拥有FDA认证的药厂共有119家,可向美国出口约900种获得FDA批准的药物和制药原料;拥有英国药品管理局认证的药厂也有80多家。印度的药品出口到200多个国家,疫苗和生物制药产品出口到150个国家。
而有百年历史的以色列公司Teva,Mylan(迈兰制药)Amerisource Bergen(美源伯根),Perrigo(培瑞克),Cardina Health(康德乐)都是仿制药界的佼佼者,以恒瑞医药(600276.SH)、中国生物制药(1177.HK)为首的仿制药大哥是否能经得住来自外部的挑战,这将是个严峻的问题。
4
小结
对于仿制药药企而言,全球统一标准是机遇也是挑战,若能把握质量与成本,走出国际性仿制药企之路,就在这次机会。以价换量的大趋势下,很多仿制药企业在逐步转型成为创新药企,那么在这个世界的变革之下,各家又将如何抓住自己的拐点呢?
作者专栏
▌【业绩会直击】联邦制药(3933.HK):业绩大幅改善,胰岛素产品迎来收获期