讲座丨小鼠到杰瑞的奇幻之旅
各位老师同学,大家下午好,我是来自中科院神经所杨辉组的姚璇。我们课题组的主要研究方向是靶向基因治疗,通过构建一些可以模拟人类疾病的小鼠模型,然后再优化靶向基因编辑的策略,进而实现基因治疗。我今天跟大家分享的题目是小鼠到杰瑞的奇幻之旅。
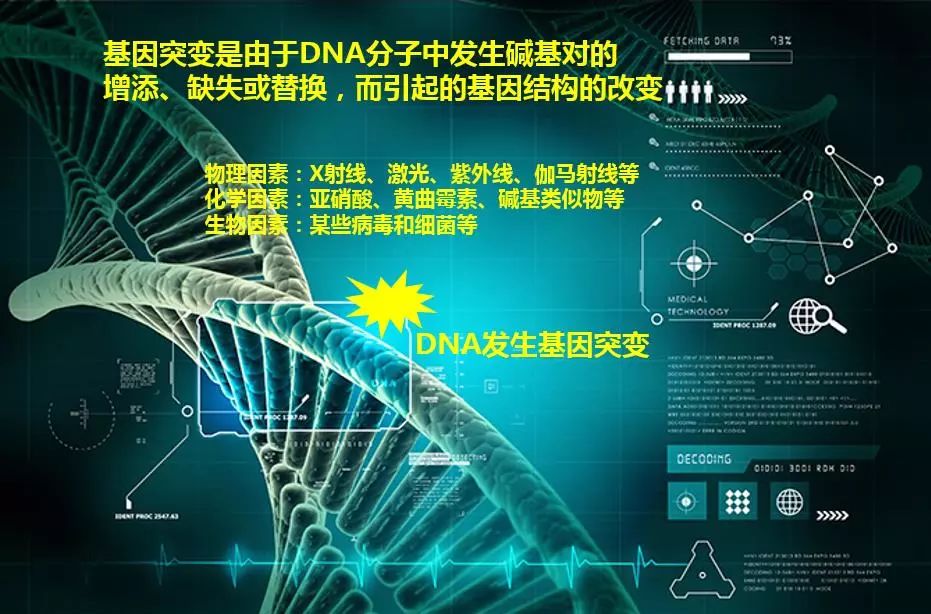
大家都知道,生命个体是由 DNA 进行编码的。我们人类成熟的个体,大概含有50万个细胞,而除了那些成熟的红细胞以及生殖细胞之外,几乎所有的细胞都含有46条染色体。这些染色体包含了大约30亿个碱基对,控制了约3万个功能基因。而基因组DNA在复制的过程中会有一定的概率发生错配或者突变,而且也有可能在外界环境影响下发生突变,比如外源病毒的整合,理化因素如紫外线辐射诱变等等。
这些基因的错误突变会导致一些相关的基因疾病,包括常染色体疾病和性染色体疾病。其中常染色体疾病包括显性致病基因导致的多指、并指、软骨发育不全等,以及隐性致病基因导致的白化病、先天性聋哑以及镰刀型贫血症等。X染色体疾病包括显性的抗维生素D 佝偻病以及隐性的血友病、红绿色盲以及进行性肌营养不良等。这些基因突变导致的疾病会影响我们的生活甚至是生命。
所以,针对这些在基因组 DNA 上发生的基因突变,我们是否可以在突变的位点进行修复,从而治疗这些疾病。在2013年,有三位科学家提出了
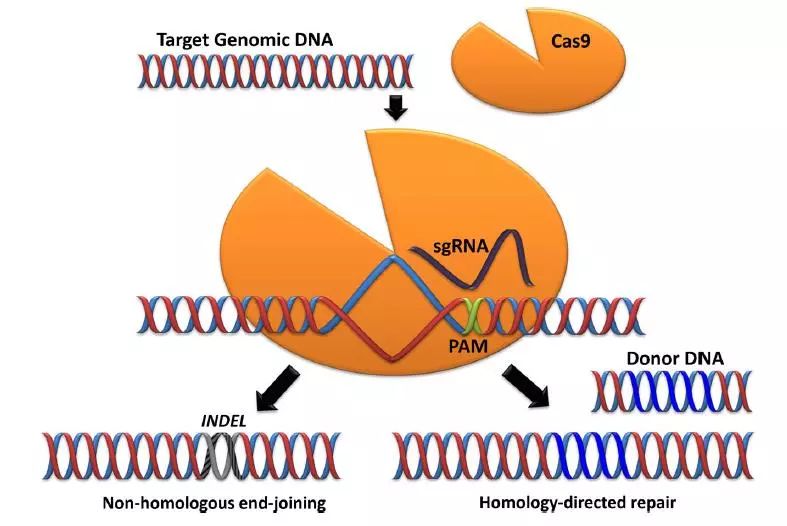
CRISPR/Cas9,它通过20bp的 sgRNA 识别特异的基因组序列,然后对特定的基因组位点进行切割造成双链断裂,被称为“基因魔剪”。有了这个技术,我们就可以针对病变的位点进行切割,然后通过敲除或引入外源修复片段对突变位点进行有效编辑,进而治疗疾病。
CRISPR/Cas9 介导的基因编辑(Waddington SN et al. Current stem cell reports 2016)
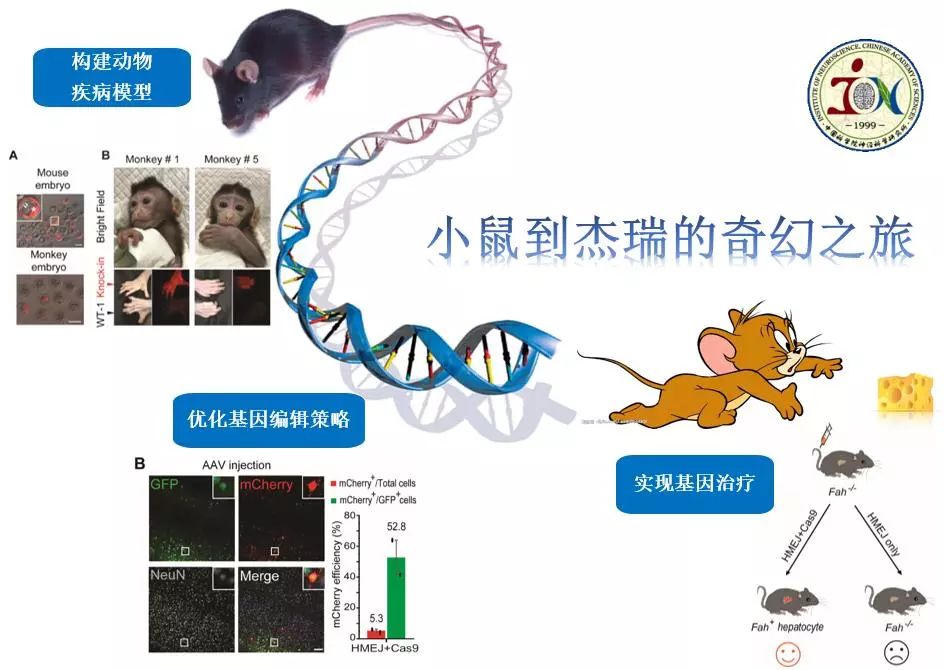
所以,今天给大家分享的小鼠到杰瑞的奇幻之旅,第一步就是将小鼠变成杰瑞,即构建动物模型去模拟人类疾病。第二步是研发高效的基因编辑策略,让剪刀进入细胞发挥“魔力”。第三步就是完成奇幻之旅,实现基因治疗。
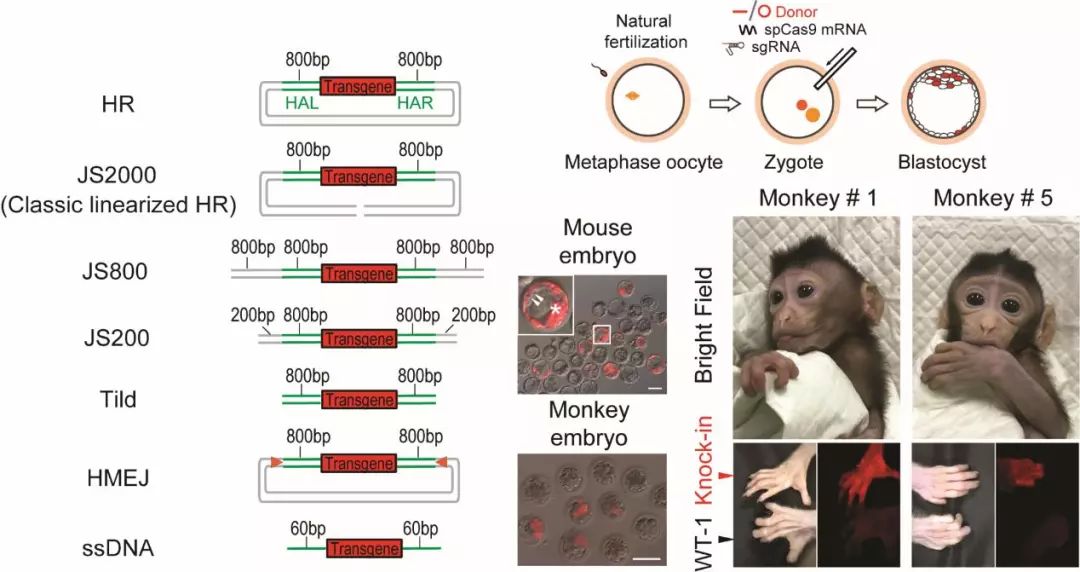
首先第一步就是从小鼠到杰瑞,构建不同的基因编辑小鼠去模拟人类疾病。主要是通过显微注射受精卵的方法,将可以改造基因组的不同元件导入到小鼠受精卵内,然后实现对小鼠基因组的靶向编辑。然后将注射过的受精卵移植到假孕受体鼠内,进而获得基因编辑的小鼠。
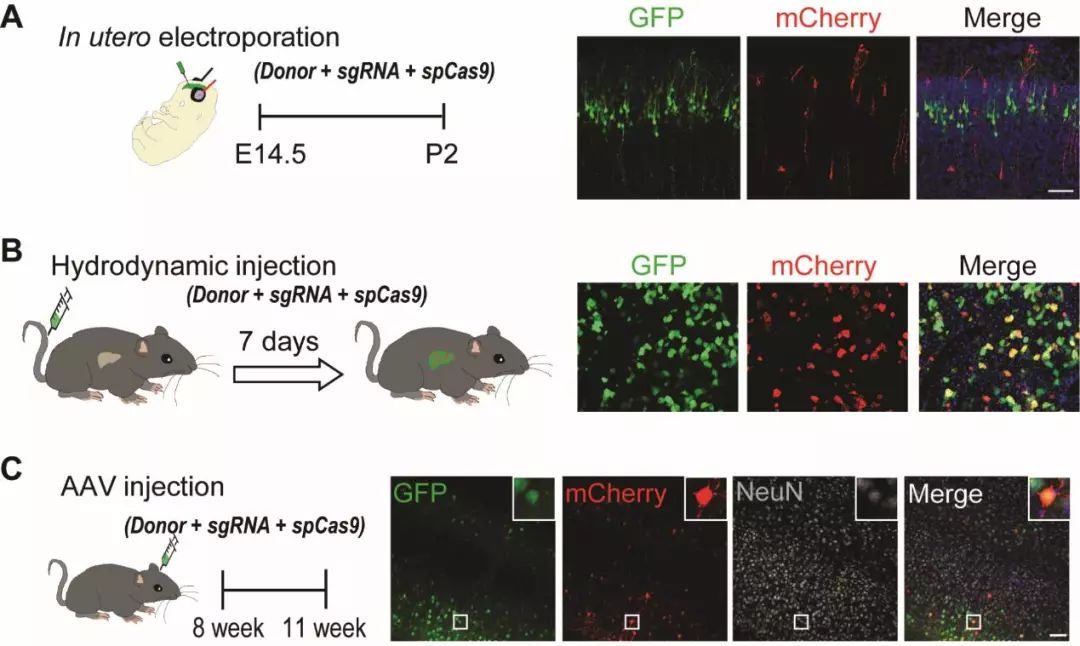
有了小鼠模型之后,就需要将“基因剪刀”运送进细胞内发挥基因编辑的魔力。现在针对人体的基因治疗主要有两种途径。一个是体外的途径,将人体的一些干细胞或者前体细胞从人体中分离出来之后,对它进行一些物理或化学的修饰,把它变成正常的细胞,再移植回人体,发挥正常的功能。另外一种方法就是在成体水平通过AAV病毒或纳米材料将修复元件导入到人体内,从而进行疾病治疗。因此,我们课题组研发了一系列的基因编辑策略,它们可以高效地在小鼠大脑神经元以及肝脏细胞中实现精确地基因编辑。
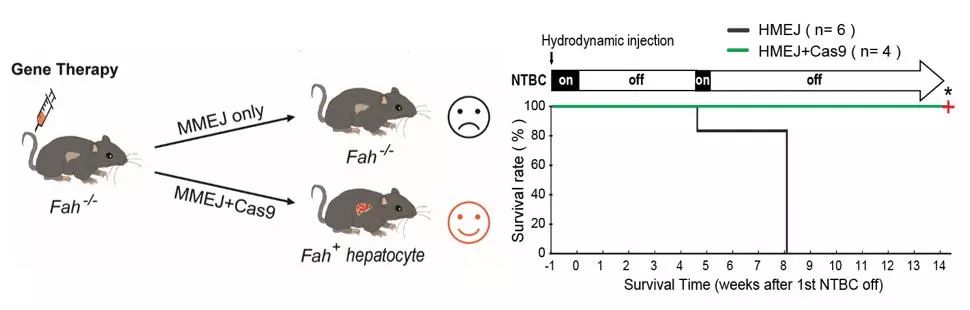
最后,小鼠模型有了,治疗策略也准备好了,那么我们是否可以实现基因治疗?为此,我们选用了一个遗传性的络氨酸血症I型(HTI)小鼠模型,它是Fah基因突变导致的先天性代谢错误疾病。Fah 表达缺失将会导致肝脏毒素累积,从而导致肝损伤和肝功能衰竭。经过基因治疗,6只对照组小鼠全部因为肝功能衰竭死亡,而6只实验组小鼠中有5只完整地存活下来。实验结果表明我们可以在体内肝细胞中实现Fah突变基因的修复,进而实现 Fah 缺陷小鼠的基因治疗。
综上所述,针对疾病的基因治疗,我们首先构建相应的动物模型,去模拟人类的一些基因突变疾病,然后优化一些可以在成体细胞内实现高效精确靶向整合的基因编辑策略,最后在小鼠模型上进行基因编辑,达到治疗疾病的目的。希望在不久的将来,我们可以把这些治疗方案应用到临床,这样就不仅仅是小鼠到杰瑞的奇幻之旅,更是病人的奇幻之旅。谢谢大家。
来源:中国科学院上海生命科学研究院神经科学研究所