Nat Commun | 中、澳、美学者合作揭示糖尿病与血栓疾病的新关联:机械力的黑暗面
撰文 居理宁 陈昀峰
在新时代,心血管疾病特征逐渐呈现糖尿病、肥胖症和代谢综合症的并发症之中。自我调节机制被打乱,血小板变得过度活跃,这些过度活跃的血小板容易黏附和沉积在未受伤的动脉血管壁表面,加速动脉粥样硬化。如果不能及时发现和治疗,将导致包括血栓、中风、冠心病等心血管类疾病。据2014年中国心血管病报告统计,全国大概有心血管病患者 2.9 亿,死亡率为 255人/10 万人;每年约 350 万人死于心血管病,占总死亡人数的40% 。更令人焦心的是,该报告预测未来十年里伴随着社会经济发展和国民生活方式、体质、人口年龄比例的变化,中国心血管疾病的患病人数还会快速增长。
2004年,著名美国心脏学家 Valentin Fuster 及同事提出了一条让世人震惊的预测:“在2000年出生的新生儿,每三个会有一个将在其人生中罹患糖尿病,而其最直接的危害就是会减短他们30%的寿命” [1]。目前中国糖尿病患者人数已达1.14亿,居全球首位。而约70%的糖尿病患者最终将死于由血小板引发的血栓所造成的心脏病或者缺血性脑中风 [2]。我们知道糖尿病可以造成血小板的生物化学变异,使其更为活化,从而更容易形成黏性血凝块,但是其内在机理目前仍不清晰。更为可惜的是,目前常用的抗血小板药物皆在抑制糖尿病血小板的活性上效果尚不理想。因此,理清糖尿病对血小板的活化影响的机理,并开发更有效的治疗手段刻不容缓!
近日,来自澳大利亚悉尼大学的 Shaun Jackson 团队与美国佐治亚理工的朱承团队展开交叉学科合作项目,旨在研究生物机械力对于血小板活化的调控作用及其和糖尿病所导致的血栓疾病之间的关联。他们最近发现一种血小板压力感应新机制,启发糖尿病引发心血管疾病的治疗方案,目前已发表在《自然·通讯》杂志 [3]。
血液循环中的细胞—血小板发生活化是造成血栓疾病的罪魁祸首。血液动力学作用力在血小板形成血栓的过程中有重要作用[4],但是之前的研究并没有探讨它与糖尿病之间的关系。与前人侧重糖尿病血小板在生物化学方面的变异不同, 该研究在血小板上首次发现了一种“挤压力感应机制”: 血小板通过对环境里挤压力的感知来调控其表面整合素分子的黏附作用。而这一生物力学机制在糖尿病的情况下被严重扰乱,从而导致在流动环境下,血小板借助整合素进行的黏附和聚合作用都更为快速稳固。考虑到糖尿病与心血管疾病的紧密联系,我们推断本工作所发现的糖尿病对血小板挤压力感应机制的扰乱或许说明,糖尿病血小板具有一种非典型性的血栓关联性,使得它对常用抗血小板药物,例如阿司匹林、氯吡格雷等等,产生可观的抗药性[5]。
令人振奋的是,在这项工作中研究者使用了一种自主研发的 I型磷脂酰肌醇3-激酶(PI3-Kinase)110b抑制剂TGX221[6]。体内和体外试验都成功表明 TGX221可以有效减弱血小板对挤压力的敏感性和生物力学刺激所导致的整合素激活, 这一重要发现或将启发我们开发针对糖尿病引起的心血管疾病的新型疗法(图1)。 目前TGX221 已经完成一期临床试验,并被英国制药公司阿斯利康(AstraZeneca)收购改名AZD6482。 2012年阿斯利康公司发表了第一份临床报告[7, 8]。
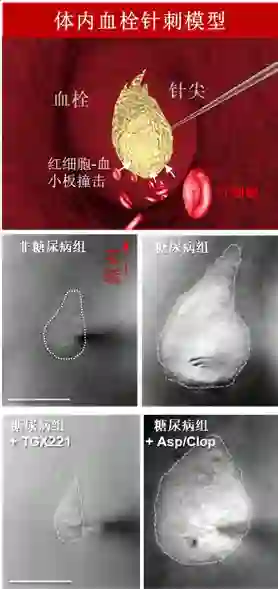
图1: 体内针刺血栓模型,该技术利用一根微米级的玻璃针扎进小鼠的血管腔内,造成血流扰动。血栓将在针尖处成形并随时间扩大规模,而其主要组成细胞为椭圆形血小板。血流中的红细胞不断地对血栓中的血小板产生撞击。在同一时刻,我们对非糖尿病小鼠和糖尿病小鼠体内的血栓表面积进行测量和比较。对于糖尿病小鼠,我们也对其进行TGX221 (2.5 mg kg-1)或阿司匹林/氯吡格雷(Asp/Clop)注射以观察这些药物对血栓形成的影响。此外,我们也在PI3Kβ-/-糖尿病小鼠上进行了对比。
这项研究由来自中国,澳大利亚和美国一共16位科研人员历时八年完成,他们分别任职于以下六所国际化研究中心:
悉尼大学心脏研究所 ;
莫纳什大学澳大利亚血液疾病研究中心 ;
Baker 心脏研究所 Danielle Alberti 糖尿病并发症研究中心;
佐治亚理工学院 Coulter 生物医学系;
埃默里大学儿科内分泌系
斯克里普斯研究所分子医学系
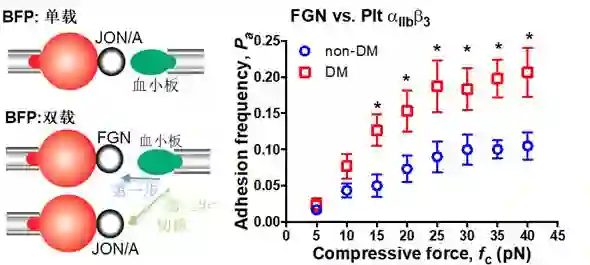
值得一提的是,其中最年轻的两位主力居理宁(31岁,第一作者)、陈昀峰(28岁,共同作者)本科先后毕业于北京大学工学院,博士师从佐治亚理工学院朱承教授,目前分别在悉尼大学心脏研究所和斯克里普斯研究所从事相关方向的博士后研究(图2,三人照片)。近年来三人推广了第二代生物膜测力仪(Biomembrane Force Probe,BFP) 用于研究血液细胞——主要是血小板与白细胞——上的单分子力感应机理 [9]。 该团队将生物膜测力仪与荧光显微镜结合,实现在活细胞上同步获取力谱和钙离子信号 [10]。通过在血小板系统上优化该技术,他们率先刻画了血小板糖蛋白Ib-IX受体传导力信号的力学机制[11]。2017年他们进一步将系统升级为双载生物膜测力仪(dual BFP)用于刻画两对受体之间的信号串扰(“crosstalk”)过程。该系统首次在单细胞上实现对上下游受体行为在时间和空间上分开量化[12]。与常规的生物化学和细胞生物学方法(通常是群体平均的和非实时的)不同,双载生物膜测力仪通过生物力学的手段对实现对多个受体的串扰行为精确控制和量化。该系统在这项研究中充分发挥威力,提供最直接证据证明压力感应的阈值存在并揭示糖尿病血小板压力感应发生异化(图3)[3]。
图2 在本工作中推广了第二代生物膜测力仪(照片左侧)的三人照片:居理宁(后左一)、陈昀峰(后右一)、朱承(前排)。在本工作中,生物膜测力仪是研究血小板如何在止血过程中感应机械力刺激的主要技术手段。
本工作的核心内容总结为:
· 发现小鼠和人类的慢性高血糖症均会造成其尚未活化的血小板表面整合素αIIbβ3黏附能力的提升。而出人意料的是,这种黏附能力的提升和血液中的红细胞有着紧密的联系。
· 通过运用单分子生物膜力学探针(BFP)对单个血小板的属性进行刻画,发现当挤压力施加在血小板表面时将会激活其表面整合素αIIbβ3,使其和纤维蛋白之间的耦合速度大幅提升,从而可以轻易实现血小板与纤维蛋白的紧密黏附(图3)。
· 上述这种由机械力造成的整合素激活需要钙离子和磷脂酰肌醇3-激酶进行信号传递,而糖尿病正是通过增强这一信号传递过程造成血小板表面整合素αIIbβ3的过度活化和血小板黏附能力的过度强化。
· 通过开展小鼠体内血栓模型实验,证实了糖尿病会引起尚未活化的血小板在血管中的聚合,其过程所倚赖的是一种生物力学机制。正常治疗剂量的阿司匹林、氯吡格雷均不能对这种生物力学机制产生抑制作用,但是如果抑制磷脂酰肌醇3-激酶则可以对其产生有效的阻断(图1)。
这项工作开发了一系列原创性实验手段,包括:1)体内针刺血栓模型,该实验手段证实了在糖尿病小鼠的体内,血流冲刷力确实能提升血小板形成血栓的能力(图1);2)单分子生物膜力学探针(BFP),运用该技术手段我们发现,血小板通过表面表达的整合素进行的细胞黏附,其强度在一定挤压力下会受到激发,得到显著提升,但是如果机械压力低于某一阈值则无法激发(图3);3)体外流动腔实验,运用该技术研究者发现血液中的红细胞能提高血小板的黏附能力,但对于糖尿病血小板的黏附能力增幅的作用更为显著。
文中的主要发现均在多个研究中心获得多位研究人员佐证,以确保其稳定性和可重复性。另外,工作的科学严谨性也反映在研究的实验设计上——研究有意通过收集多条平行证据的方法对主要结论进行有力支持,其中采用了不同的实验手段,包括对单个血小板进行的力谱分析、全血体外流动腔实验和小鼠体内血栓活体显微镜成像实验。这些多样性的实验技术在人体细胞和小鼠体内所得到的实验结论具有高度一致性,并均无一例外地支持文章的主要结论。
图3:单载和双载生物膜测力仪介绍和血小板压力感应实验结果
参考文献
1.Moreno, P.R. and V.Fuster, New aspects in the pathogenesisof diabetic atherothrombosis. J Am Coll Cardiol, 2004. 44(12): p. 2293-2300.
2. Jackson,S.P., Arterial thrombosis--insidious,unpredictable and deadly. Nat Med, 2011. 17(11): p. 1423-1436.
3. Ju,L., et al., Compression force sensingregulates integrin alphaIIbbeta3 adhesive function on diabetic platelets.Nat Commun, 2018. 9(1): p. 1087.
4. Nesbitt,W., et al., A shear gradient–dependentplatelet aggregation mechanism drives thrombus formation. Nat Med, 2009. 15(6): p. 665-673.
5. McFadyen,J.D. and K. Peter, Novel AntithromboticDrugs on the Horizon: The Ultimate Promise to Prevent Clotting While AvoidingBleeding. Circ Res, 2017. 121(10):p. 1133-1135.
6. Jackson,S.P., et al., PI 3-kinase p110beta: a newtarget for antithrombotic therapy. Nat Med, 2005. 11(5): p. 507-514.
7. Nylander,S., et al., Human target validation ofphosphoinositide 3-kinase (PI3K)beta: effects on platelets and insulinsensitivity, using AZD6482 a novel PI3Kbeta inhibitor. J Thromb Haemost,2012. 10(10): p. 2127-36.
8.Jackson,S.P. and S.M. Schoenwaelder, Antithromboticphosphoinositide 3-kinase beta inhibitors in humans: a 'shear' delight! JThromb Haemost, 2012. 10(10): p.2123-6.
9. Chen,Y., et al., Receptor-mediated cellmechanosensing. Mol Biol Cell, 2017.
10. Chen,Y., et al., Fluorescence BiomembraneForce Probe: Concurrent Quantitation of Receptor-ligand Kinetics andBinding-induced Intracellular Signaling on a Single Cell. J Vis Exp,2015(102): p. e52975.
11. Ju,L., et al., Cooperative unfolding ofdistinctive mechanoreceptor domains transduces force into signals. Elife,2016. 5.
12. Ju,L., et al., Dual Biomembrane Force Probeenables single-cell mechanical analysis of signal crosstalk between multiplemolecular species. Sci Rep, 2017. 7(1):p. 14185.
阅读更多
▽ 故事
· 科学界第一巨奖新一轮全球提名:“科学突破奖”诚邀中国研究者参与
· 广义相对论是错的?引力波验证了广义相对论,却可能揭示其缺陷
· 他们选择用水焚葬与世界作别,将肉体还原为建造生命的“积木”
· 诺奖评委因他引咎辞职,经手患者多在短期内离世:一位“名医”对科学的重创
▽ 论文推荐
· 上海交大但亚平课题组:光霍尔效应揭示纳米线光电导的增益原理| ACS Nano论文推荐
▽ 论文导读
内容合作请联系
keyanquan@huanqiukexue.com