J Control Release:肿瘤外泌体可靶向递送CRISPR/Cas9促进肿瘤细胞凋亡
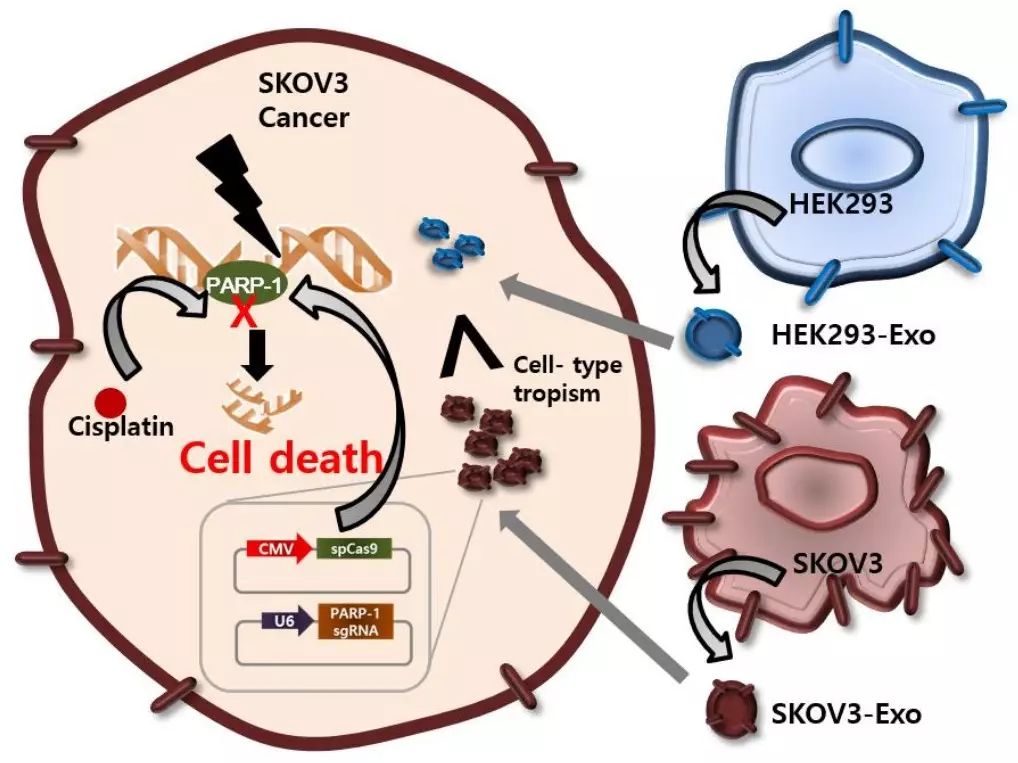
CRISPR/Cas9的细胞内递送系统对于其在各类疾病中作为治疗性基因组编辑技术的应用至关重要。现有的携带CRISPR/Cas9的载体由于低耐受性和免疫原性而限制了其体内递送;因此,基因组编辑的体内递送仍然具有挑战性。来自韩国科学技术研究院的研究人员在最新一期的J Control Release杂志上发表文章,报道了癌症外泌体作为天然载体可将CRISPR/Cas9质粒有效地传递到癌症细胞。与上皮细胞外泌体相比,癌症外泌体可在SKOV3异种移植小鼠的卵巢癌肿瘤中选择性积累,这提供了有效的体内递送途径,原因最有可能是由于其特定细胞的倾向性。CRISPR/Cas9加载的外泌体可抑制poly(ADP-核糖)聚合酶-1(PARP-1)的表达,从而诱导卵巢癌细胞凋亡。此外,通过CRISPR/Cas9介导的基因组编辑对PARP-1的抑制增强了顺铂的化学敏感性,显示出协同的细胞毒性。基因编辑和化学治疗的联合治疗可协同降低癌细胞活力,这与癌细胞的凋亡显著增加有关。基于这些结果,未来利用肿瘤外泌体作为载体治疗癌症可能是非常有希望的。
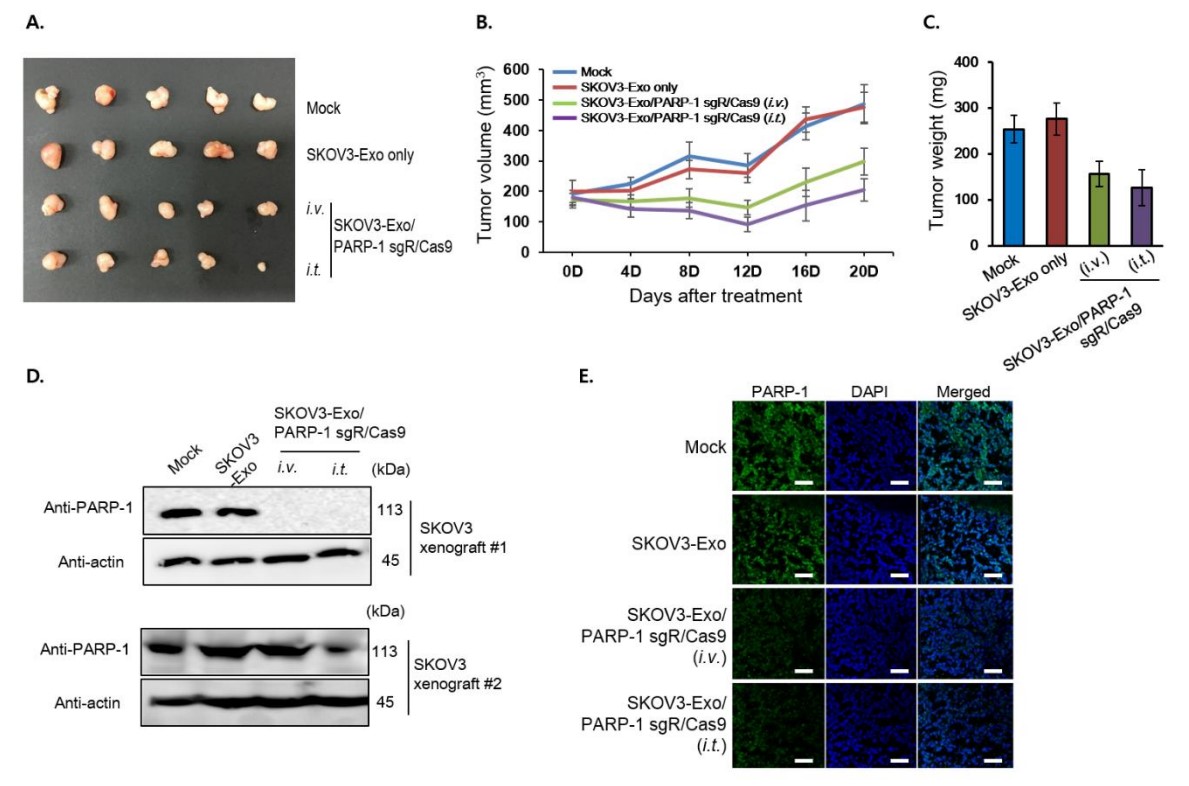
在SKOV3异种移植动物模型中载有CRISPR/Cas9的外泌体的抗癌作用。CRISPR/Cas9加载的外泌体静脉内和肿瘤内间隔3天两次给药。(A)初次注射后第28天切除肿瘤。(B)从注射当天开始测量肿瘤生长。(C)实验终点时小鼠的肿瘤重量。(D,E)通过免疫印迹分析(D)和异种移植物切除的肿瘤中的免疫荧光染色(E)分析PARP-1的水平。对于Western印迹,使用两个单独的肿瘤。
参考文献:Kim SM, Yang Y, Oh SJ, Hong Y, Jang M. Cancer-derived exosomes as a delivery platform of CRISPR/Cas9 confer cancer cell tropism-dependent targeting. J Control Release. 2017 Sep 12. pii: S0168-3659(17)30846-5. doi: 10.1016/j.jconrel.2017.09.013. [Epub ahead of print]
科研学习班推荐 (点击详细了解):