公开征求《肿瘤相关突变基因检测试剂(高通量测序法)性能评价通用技术审查指导原则(征求意见稿)》意见
近日,燃石医学和诺禾致源两款基于NGS的多基因肿瘤基因检测试剂盒相继获批,备受业内广泛关注。紧接着,8月14日,国家食品药品监督管理总局和医疗器械技术审评中心发布了关于公开征求《肿瘤相关突变基因检测试剂(高通量测序法)性能评价通用技术审查指导原则(征求意见稿)》意见的通知。
7月23日,国家食品药品监督管理总局发布了《2018年07月23日准产批件发布通知》,其中由广州燃石医学检验所有限公司申请的“EGFR/ALK/BRAF/KRAS基因突变联合检测试剂盒(可逆末端终止测序法)”获得准产批件,该产品将成为中国首个获得CFDA批准的NGS肿瘤多基因检测试剂盒。该试剂盒是中国首个基于高通量测序技术(NGS)以及伴随诊断标准审批的多基因肿瘤突变联合检测试剂盒,将用于帮助非小细胞肺癌患者精准选择靶向药物治疗的方式。
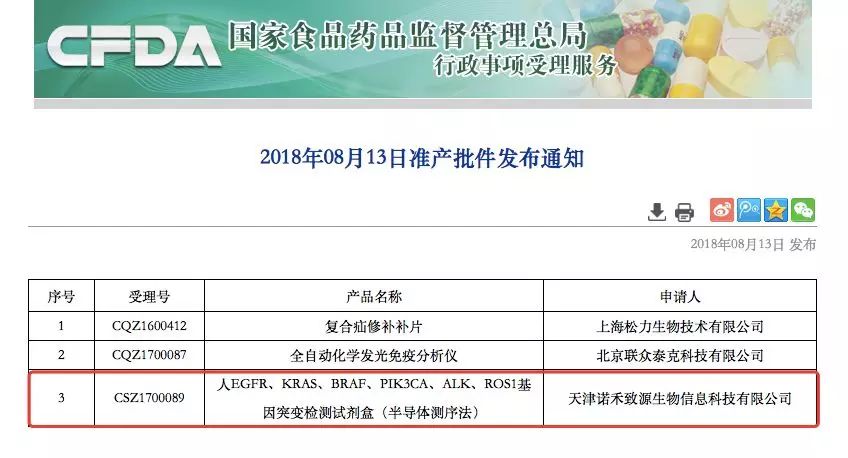
8月13日,国家药品监督管理局通过创新医疗器械特别审批通道,批准天津诺禾致源生物信息科技有限公司“人EGFR、KRAS、BRAF、PIK3CA、ALK、ROS1基因突变检测试剂盒(半导体测序法)”的III类医疗器械产品上市。该产品批准用于检测非小细胞肺癌(NSCLC)患者肿瘤组织中与靶向治疗密切相关的六个基因的突变状态,筛选适合接受靶向药物治疗的患者。
8月14日,为进一步规范肿瘤相关突变基因检测产品的注册申报和技术审评,提高审评效率,统一审评尺度,国家食品药品监督管理总局和医疗器械技术审评中心发布关于公开征求《肿瘤相关突变基因检测试剂(高通量测序法)性能评价通用技术审查指导原则(征求意见稿)》意见的通知。
肿瘤相关突变基因检测试剂(高通量测序法)性能评价通用技术审查指导原则
End
登录查看更多
相关内容
Arxiv
4+阅读 · 2018年2月27日