Sciense:熬夜会发胖!中国科学家发现都是肠道菌群搞的鬼!
点击上方“转化医学网”订阅我们!
干货 | 靠谱 | 实用

Lora Hooper博士及其研究生Yuhao Wang
9月1日,国际顶级期刊《科学》在线刊登了一项重量级研究成果:
机体肠道微生物可以协同昼夜节律生物钟共同调节机体脂肪摄入和储存过程!
该项研究由美国德克萨斯大学西南医学中心免疫研究所的Lora V. Hooper教授领导, Hooper教授长期致力于肠道微生物以及机体营养代谢之间的研究。

“人类的肠道中充满了数以万计的微生物,这些微生物帮助我们消化食物,保护我们免受病毒感染,且可以产生某些维生素。”Hooper实验室的研究生兼该文章的第一作者Wang说道,“以前已经有研究表明,生活在我们肠道中的某些细菌可能会使我们体重增加,特别是当我们消费高脂肪,高糖“西式”食物时。”
在这项研究中,研究人员意外的发现:
与无菌小鼠相比,含有肠道微生物的正常小鼠小肠上皮细胞中NFIL3转录因子的表达量显著上调近70%。
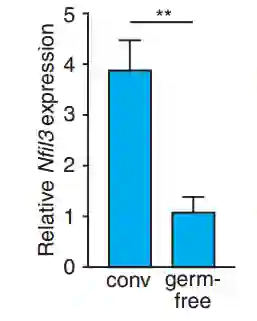
无菌小鼠和有肠道微生物的小鼠
NFIL3转录因子的表达量对比
根据先前的报道,NFIL3转录因子恰好能够促进小肠上皮细胞对膳食脂肪酸的摄取以及脂肪的储存。
这进一步说明:肠道微生物可能是通过调节NFIL3转录因子的表达来调节脂肪代谢。
为了证明这一点,研究人员分别对无菌小鼠、正常小鼠以及NFIL3基因敲除小鼠进行了为期10周的高脂肪饮食喂养实验。
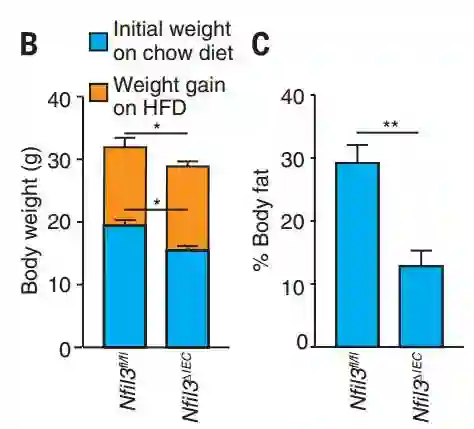
无菌小鼠和基因敲除小鼠体重和体脂对比
研究人员发现:
与正常小鼠相比,无菌小鼠和NFIL3基因敲除小鼠的脂肪吸收和储存量显著减少。这表明,肠道微生物促进脂肪吸收和储存确实是通过调节NFIL3转录因子表达实现的。
那么肠道微生物菌群究竟如何通过NFIL3转录因子来调节脂肪摄取和储存的呢?
先前的研究表明,细胞内存在一种能够抑制NFIL3表达的蛋白,即REV-ERBa蛋白。
肠道菌群可以通过分泌物与小肠免疫细胞相互作用,进而激活一系列信号转导过程抑制小肠细胞内REV-ERBa蛋白的表达以提高NFIL3的转录,最终促进小肠上皮细胞对脂肪的摄取和储存。
Hooper教授解释道:”肠道内缺乏微生物菌群的无免疫小鼠的NFIL3表达量低于正常小鼠平均水平,意味着他们会摄取和储存更少的脂肪,因此即使是长期高脂肪饮食这些小鼠的体重也会控制在一定范围内。”
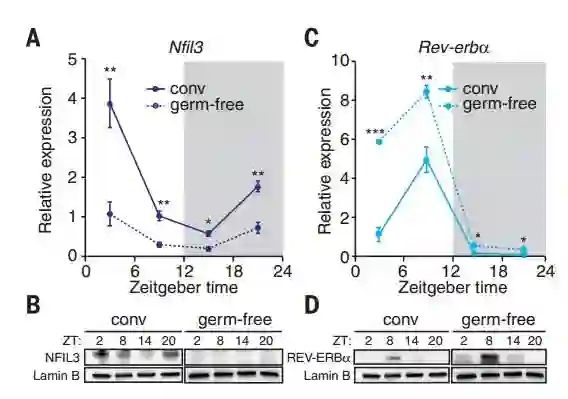
无菌小鼠和有肠道菌群的小鼠体内的NFIL3(B)和REVERBa同光纤(睡眠节律)变化对比
机体的昼夜节律生物钟会根据需要打开或关闭代谢过程。即使小肠细胞不直接暴露于光照下,其昼夜节律时钟也可以捕获来自视觉和神经系统的光线,并调节细胞内相关基因的表达,最终可以达到调节机体营养代谢的目的。
Hooper教授领导的这项研究工作更深入的分析了昼夜节律如何与肠道微生物菌群相互作用,以及这种相互作用如何影响机体新陈代谢。
同时这也可以解释为什么夜间工作者或频繁需要飞行的人患代谢疾病如肥胖,糖尿病和心血管疾病的概率更高。
END




